
在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=________(写计算式).如果实验中加热温度过高,固体颜色变黑,则测定结果会________(填“不变”、“偏高”、“偏低”).
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:058
在测定硫酸铜结晶水的实验操作中:
(1)加热前应将晶体放在________中研碎,加热是放在________中进行的,加热失水后,应放在中冷却。
(2)判断是否完全失去结晶水的方法是________。
(3)做此实验,最少应进行称量操作________次。
(4)下面是某学生的一次实验数据,完成计算,填入表的空格中。
坩埚质量 11.7g
坩埚与晶体总质量 22.7g
加热后坩埚与固体总质量 18.6g
测得晶体中结晶水个数
误差(偏高或偏低)
(5)这次实验中产生误差的原因可能是下列各点中的________所造成的(填A、B、C、D)。
A.硫酸铜晶体中含不挥发性杂质
B.加热过程中有晶体溅失
C.实验前晶体表面潮湿存水
D.最后两次称量质量相差较大
查看答案和解析>>
科目:高中化学 来源: 题型:
A.在盐酸与氢氧化钠溶液的中和热测定的实验过程中,最少需要测定并记录温度的次数是3次
B.在硫酸铜晶体中结晶水含量测定的实验中,在实验过程中最少称量4次
C.在某有机物分子中含n个—CH2—,m个![]() ,a个—CH3,其余为羟基,则含羟基的个数最多为m-a+2
,a个—CH3,其余为羟基,则含羟基的个数最多为m-a+2
D.在有机物 分子中处于同平面内的碳原子数最多有13个
分子中处于同平面内的碳原子数最多有13个
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期12月月考化学试卷(解析版) 题型:填空题
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+
N2(g)。△H<0
2CO2(g)+
N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
| A电极 | B电极 | X溶液 |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
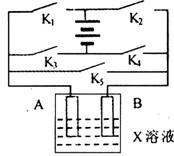
①甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为__________;
②乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为:__________,实验时应闭合的电键的组合是:__________(从下列五项中选择所有可能组合,第三小题也在这五项中选择)。
A.K1和K2 B.K1和K3 C.K1和K4 D.K2和K3 E.K2和K4
③丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐中应含的阳离子的化学式为__________,实验时,应闭合的电键的组合是:__________(选项如上)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量得KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、(5分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)![]() 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到
t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) ![]() N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com