
分析 A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,A为氢元素,B原子最外层电子数是内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为碳元素,D、E为同主族元素,且E的原子序数为D的2倍,D为氧元素,E为硫元素,故C为氮元素,F元素在地壳中含量位于金属元素的第二位,F为Fe元素.
(1)根据核外电子排布规律书写Fe元素价层电子排布式;
(2)B2A2为C2H2,分子中H原子不满足8电子结构,含有2个C-H键、1个C≡C三键,单键为σ键,三键中含有1个σ键、2个π键.C-H为极性键,C≡C三键是非极性键,为对称结构,属于非极性分子.分子中C原子采取sp杂化,故C-H键为s-sp σ键;
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则为CO2与N2O;
(4)N元素原子2p能级有3个电子,为半满稳定状态,能量较低;
(5)D、E的氢化物分别为H2O、H2S,水分子之间形成氢键,沸点高于硫化氢的,H2S分子中S原子成2个S-H键,含有2对孤电子对,价层电子对为4;
(6)晶胞的体积V=r3(r为棱长),计算晶胞中含有Fe原子数目,结合Vρ=N×$\frac{56}{{N}_{A}}$计算密度之比(N代表晶胞中Fe原子数目);
面心立方晶胞中,以顶点的Fe分析,与之最近的Fe原子位于面心上,每个Fe原子周围有12个Fe原子,体心立方晶胞中以体心的Fe分析,与之最近的Fe原子处于顶点上,每个Fe原子周围有8个Fe原子.
解答 解:已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,A为氢元素,B原子最外层电子数是内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为碳元素,D、E为同主族元素,且E的原子序数为D的2倍,D为氧元素,E为硫元素,故C为氮元素,F元素在地壳中含量位于金属元素的第二位,F为Fe元素.
(1)Fe元素是26号元素,价层电子排布式为3d64s2,故答案为:3d64s2;
(2)B2A2为C2H2,
A.分子中H原子不满足8电子结构,故A错误;
B.含有2个C-H键、1个C≡C三键,单键为σ键,三键中含有1个σ键、2个π键,σ键与π键之比为3:2,故B错误;
C.C-H为极性键,C≡C三键是非极性键,为对称结构,属于非极性分子,故C正确;
D.分子中C原子采取sp杂化,故C-H键为s-spσ键,故D正确;
故答案为:CD;
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则为CO2与N2O,CO2的结构式为O=C=O,
故答案为:O=C=O;
(4)N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定,失去第一的电子需要的能量比C、O多,
故答案为:N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定;
(5)D、E的氢化物分别为H2O、H2S,水分子之间形成氢键,硫化氢分子之间为范德华力,氢键比范德华力更强,故水的沸点高于硫化氢的,H2S分子中S原子成2个S-H键,含有2对孤电子对,价层电子对为4,价层电子对互斥模型为四面体形,S原子的杂化方式为sp3,
故答案为:H2O分子间存在氢键较H2S分子间的范德华力强;四面体形;sp3;
(6)面心立方晶胞边长为acm,体积V=a3,含有Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故a3ρ(面心)=4×$\frac{56}{{N}_{A}}$,
体心立方晶胞边长为bcm,体积V=b3,含有Fe原子数目为8×$\frac{1}{8}$+1=2,故b3ρ(体心)=2×$\frac{56}{{N}_{A}}$,故ρ(面心):ρ(体心)=2b3:a3.
面心立方晶胞中每个Fe原子周围有12个Fe原子,体心立方晶胞中每个Fe原子周围有8个Fe原子,故Fe原子配位数之比为12:8=3:2,
故答案为:2b3:a3;3:2.
点评 本题目综合性较大,涉及核外电子排布规律、化学键、分子极性与空间结构、电离能、价层电子对互斥理论、杂化轨道理论、电子式、晶胞计算,是对物质结构的综合考查,难度中等,需要对知识全面掌握理解.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
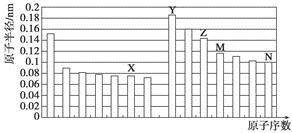
| A. | Z、N两种元素的离子半径相比,前者较大 | |
| B. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| C. | 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com