
 ,B的结构简式为OGC-CHO.
,B的结构简式为OGC-CHO.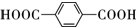
 .
. .
.分析 (1)有机物A只含C、H、O三种元素,A经催化氧化生成B,B经催化氧化生成C,为醇→醛→酸的转化,氧元素的质量分数为$\frac{16}{31}$,其相对分子质量为62,则氧原子数目为2,A与C在一定条件下反应可生成一种环状化合物F,说明A至少含有两个羟基,可推知A为HOCH2CH2OH,B为OHC-CHO,C为HOOC-COOH;
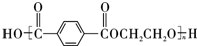
(2)①E的蒸汽密度是同温同压下氧气密度的5.19倍,则E的相对分子质量为32×5.19=166,②完全燃烧16.6g有机物E,得到35.2g CO2和5.4g H2O,E为0.01mol、二氧化碳为0.8mol、水为0.3mol,则E的分子式C8H6O4,③核磁共振氢谱显示E分子中只有2种不同结构位置的氢原子,④E为无色晶体,微溶于水,易溶于Na2CO3溶液,放出无色气体,说明E中含有-COOH,则E为 ;
;
(3)乙二醇与 发生缩聚反应得到高聚物;
发生缩聚反应得到高聚物;
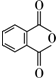
(4)E的一种同分异构体(与E具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物F,应是邻苯二甲酸脱水;
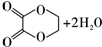
(5)草酸可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,草酸被氧化为二氧化碳.
解答 解:(1)有机物A只含C、H、O三种元素,A经催化氧化生成B,B经催化氧化生成C,为醇→醛→酸的转化,氧元素的质量分数为$\frac{16}{31}$,其相对分子质量为62,则氧原子数目为2,A与C在一定条件下反应可生成一种环状化合物F,说明A至少含有两个羟基,可推知A为HOCH2CH2OH,B为OHC-CHO,C为HOOC-COOH,A与C反应生成D的反应方程式为:HOOC-COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$ ,属于取代反应(或酯化反应),
,属于取代反应(或酯化反应),
故答案为:取代反应(或酯化反应);HOOC-COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$ ;OHC-CHO;
;OHC-CHO;
(2)①E的蒸汽密度是同温同压下氧气密度的5.19倍,则E的相对分子质量为32×5.19=166,②完全燃烧16.6g有机物E,得到35.2g CO2和5.4g H2O,E为0.01mol、二氧化碳为0.8mol、水为0.3mol,则E的分子式C8H6O4,③核磁共振氢谱显示E分子中只有2种不同结构位置的氢原子,④E为无色晶体,微溶于水,易溶于Na2CO3溶液,放出无色气体,说明E中含有-COOH,则E为 ,
,
故答案为:C8H6O4; ;
;
(3)乙二醇与 发生缩聚反应得到高聚物,该高分子化合物的结构简式为
发生缩聚反应得到高聚物,该高分子化合物的结构简式为 ,
,
故答案为: ;
;
(4)E的一种同分异构体(与E具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物F,应是邻苯二甲酸脱水,F的结构简式为: ,故答案为:
,故答案为: ;
;
(5)草酸可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,草酸被氧化为二氧化碳,反应离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
点评 本题考查有机物推断、官能团的结构与性质、氧化还原反应等,掌握燃烧法利用原子守恒确定有机物分子式,熟练掌握官能团的性质,难度中等.


科目:高中化学 来源: 题型:解答题
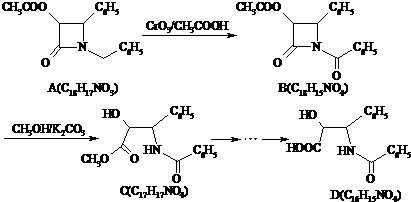
 .
.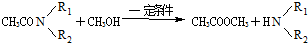
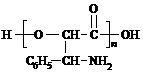 或
或 ;
;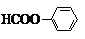 或
或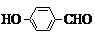 .
.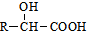 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl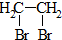
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
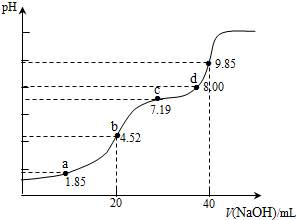
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com