
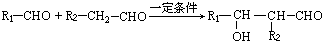
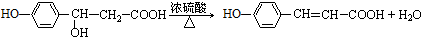
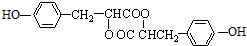 .
.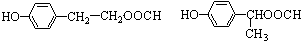 任意一种.
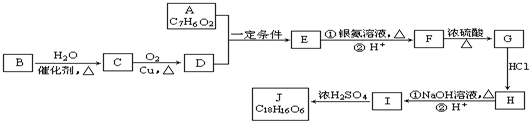
任意一种.分析 A既能发生银镜反应,说明含有醛基,又能与FeCl3溶液发生显色反应,说明含有酚羟基,其核磁共振氢谱显示有4种氢,且峰面积之比为1:2:2:1,结合A的分子式可知,A的结构简式为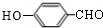 .有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则B为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生氧化反应得D为CH3CHO,A既能发生银镜反应,又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,其核磁共振氢谱显示有4种氢,A与D发生题中信息中的反应生成E为
.有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则B为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生氧化反应得D为CH3CHO,A既能发生银镜反应,又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,其核磁共振氢谱显示有4种氢,A与D发生题中信息中的反应生成E为 ,E发生氧化反应生成F为
,E发生氧化反应生成F为 ,F在浓硫酸作用下发生消去反应生成G为
,F在浓硫酸作用下发生消去反应生成G为 ,根据J的分子中含有3个六元环可知,G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为
,根据J的分子中含有3个六元环可知,G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为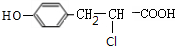 ,H在碱性条件下发生水解生成I为
,H在碱性条件下发生水解生成I为 ,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为
,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为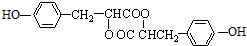 ,据此解答.
,据此解答.
解答 解:A既能发生银镜反应,说明含有醛基,又能与FeCl3溶液发生显色反应,说明含有酚羟基,其核磁共振氢谱显示有4种氢,且峰面积之比为1:2:2:1,结合A的分子式可知,A的结构简式为 .有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则B为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生氧化反应得D为CH3CHO,A既能发生银镜反应,又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,其核磁共振氢谱显示有4种氢,A与D发生题中信息中的反应生成E为
.有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平,则B为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生氧化反应得D为CH3CHO,A既能发生银镜反应,又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,其核磁共振氢谱显示有4种氢,A与D发生题中信息中的反应生成E为 ,E发生氧化反应生成F为
,E发生氧化反应生成F为 ,F在浓硫酸作用下发生消去反应生成G为
,F在浓硫酸作用下发生消去反应生成G为 ,根据J的分子中含有3个六元环可知,G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为
,根据J的分子中含有3个六元环可知,G与氯化氢发生加成反应,氯原子加在羧基邻位碳上,生成H为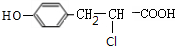 ,H在碱性条件下发生水解生成I为
,H在碱性条件下发生水解生成I为 ,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为
,两分子I在浓硫酸作用下发生成酯化反应,生成环酯J为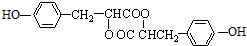 .
.
(1)A为 ,含有的官能团名称是:醛基、羟基,故答案为:醛基、羟基;
,含有的官能团名称是:醛基、羟基,故答案为:醛基、羟基;
(2)B→C属于加成反应,F→G属于消去反应,故答案为:加成反应;消去反应;
(3)F生成G的化学方程式为: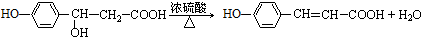 ,
,
故答案为: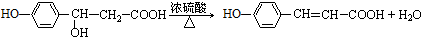 ;
;
(4)J的结构简式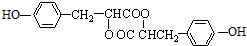 ,
,
故答案为: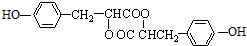 ;
;
(5)E( )的同分异构体有多种,其中一种符合以下要求:
)的同分异构体有多种,其中一种符合以下要求:
①与FeCl3溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,说明含有醛基,③苯环上只有两个对位取代基,④能发生水解反应,说明含有酯基,符合条件的同分异构体: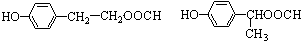 ,
,
故答案为: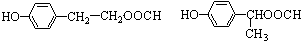 任意一种.
任意一种.
点评 本题考查有机物的推断与合成,关键是分析确定A的结构简式,再结合反应条件、J的结构推断进行推断,需要学生熟练掌握官能团的性质与转化,题目难度中等.


科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列化学用语表达正确的是
A.硫原子的结构示意图: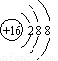
B.氯化氢分子的电子式: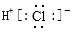
C.乙烯的结构简式:CH2CH2
D.碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④⑥⑧ | C. | ①②③④⑤ | D. | ②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
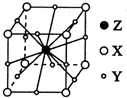 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.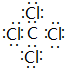
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
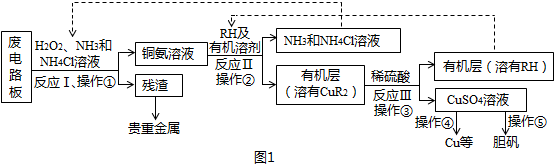
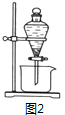
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe2++2Br2+6Cl- | |
| B. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| C. | 酚酞滴入碳酸钠溶液中,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | 将铝条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原生铜的硫化物具有还原性 | |
| B. | 常温时ZnS、PbS、CuS都难溶于水,CuSO4可溶于水 | |
| C. | 铜蓝的形成过程是:ZnS(S)+Cu2+?CuS(S)+Zn2+ | |
| D. | 硝酸型酸雨不利于铜蓝的形成:CuS+2H+═Cu2++H2S↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com