
【题目】下列关于物质的量及粒子数的叙述,正确的是( )
A. 1 mol任何物质都含有6.02×1023个分子
B. 0.012 kg 12C中含有约6.02×1023 个12C
C. 1 mol CO2中含有1 mol碳和2 mol氧
D. 1 mol H含有6.02×1024个质子
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验。
[分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是_____________________。
(2)质谱仪测定该有机化合物的相对分子质量为46,则该物质的分子式是 。
(3)根据价键理论,预测A的可能结构并写出其结构简式 。
[结构式的确定]
(4)1H核磁共振谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子(如图1)。经测定,有机物A的1H核磁共振谱示意图如图2所示,则A的结构简式为 。

图1 图2
[性质实验]
(5)A在一定条件下脱水可生成B,B可合成塑料C,请写出B转化为C的化学方程式:_______________
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27 ℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应的化学方程式:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素最高价氧化物对应的水化物之间两两皆能反应。请回答下列问题:
(1)B元素的原子结构示意图是______________;D元素在周期表中的位置是第________周期________族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式:_______________________,_______________________________。
(3)写出E2C3分别与盐酸和氢氧化钠溶液反应的离子方程式:_______________________________ ,_________________________________。
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为_____________________________________________________。
(5)A、C、F间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_______________________________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________(填序号)。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。回答下列问题:
(1)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=____________________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述正确的是( )
A. 所有的金属常温下都呈固态
B. 金属单质在化学反应中往往体现出还原性
C. 金属都能在空气中形成致密的保护膜
D. 金属元素在自然界中都是以化合态形式存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
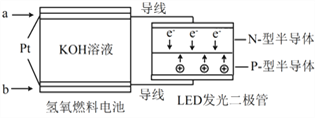
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com