
分析 ①浓硫酸物质的量浓度=$\frac{1000ρω}{M}$;
②稀释前后溶质的物质的量不变,据此计算稀释后稀硫酸物质的量浓度,氢离子浓度是硫酸的2倍,据此计算稀释后氢离子浓度.
解答 解:①浓硫酸物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4mol/L;
②稀释前后溶质的物质的量不变,则稀释后硫酸物质的量浓度=$\frac{18.4mol/L×0.25L}{1L}$=4.6mol/L,硫酸溶液中氢离子浓度是硫酸的2倍,则稀释后氢离子浓度=4.6mol/L×2=9.2mol/L,
故答案为:9.2mol/L.
点评 本题考查物质的量浓度计算,为高频考点,明确各个物理量之间的关系式是解本题关键,侧重考查学生分析计算能力,注意密度、质量分数与物质的量浓度的关系,为易错题.


科目:高中化学 来源: 题型:选择题
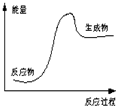
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
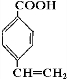 .
.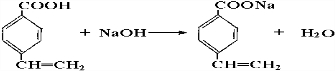 .
.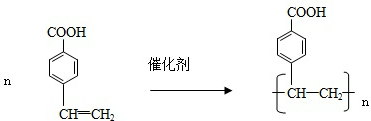 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 联碱法对母液的处理方法是向母液中通入二氧化碳,冰冻和加食盐 | |
| B. | 列管式热交换器的使用实现了原料的充分利用 | |
| C. | 焙烧辰砂制取汞的反应原理为:HgS+O2$\stackrel{焙烧}{→}$Hg+SO2 | |
| D. | 氯碱工业、铝的冶炼、牺牲阳极的阴极保护法都是应用了电解池的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
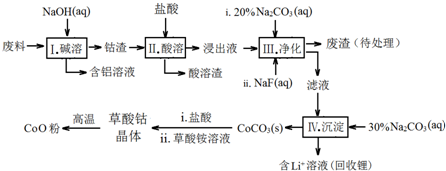
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com