
【题目】现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
(1)A中铁与浓硫酸发生反应的化学方程式是 , 反应中浓硫酸表现出的性质是 .
(2)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后 , 则证明装置的气密性良好.
(3)装置C的作用 .
(4)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.铁碳合金中铁的质量分数为(写表达式).
(5)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是 .
(6)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数还会偏高.你认为其中的原因是 .
【答案】
(1)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性
Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性
(2)把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管,产生一段水柱
(3)除去CO2中的SO2
(4)![]() ×100%
×100%
(5)E装置后再连接一个盛碱石灰的干燥管
(6)反应产生的CO2气体未能完全排到装置E中,导致b偏低
【解析】解:(1)铁和浓硫酸加热反应生成硫酸铁、二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,在该反应中部分硫元素从+6价降为+4价,同时生成硫酸铁,所以硫酸表现出的性质是酸性和氧化性;
Fe2(SO4)3+3SO2↑+6H2O,在该反应中部分硫元素从+6价降为+4价,同时生成硫酸铁,所以硫酸表现出的性质是酸性和氧化性;
所以答案是:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性;(2)关闭分液漏斗的活塞,在E装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性;(2)关闭分液漏斗的活塞,在E装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
所以答案是:把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管,产生一段水柱;(3)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 ;
所以答案是:除去CO2中的SO2;(4)称取ag铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则ag铁碳合金中含碳元素的质量为 ![]() =
= ![]() g,则含铁的质量为ag﹣
g,则含铁的质量为ag﹣ ![]() g,铁的质量分数为
g,铁的质量分数为 ![]() ×100%;
×100%;
所以答案是: ![]() ×100%;(5)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;
×100%;(5)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;
所以答案是:E装置后再连接一个盛碱石灰的干燥管;(6)装置中生成的二氧化碳不能全部被碱石灰吸收会导致测定结果偏低,
所以答案是:反应产生的CO2气体未能完全排到装置E中,导致b偏低.


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.FeO是碱性氧化物
B.用加热法分离泥沙中的碘单质是化学变化
C.丁达尔效应可用于区分胶体和溶液
D.Fe2O3+3CO ![]() 2Fe+3CO2 是复分解反应
2Fe+3CO2 是复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置制备并检验Cl2的性质.下列说法正确的是( ) 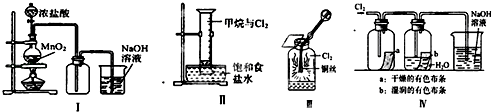
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。
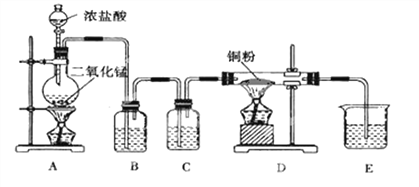
请回答下列问题:
(1)B中选用的试剂是饱和食盐水,其作用是_____;C中选用的试剂是________,其作用是_____________。
(2)D中反应的化学方程式是__________,将此生成物溶于少量水,得到_____色溶液。
(3)某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
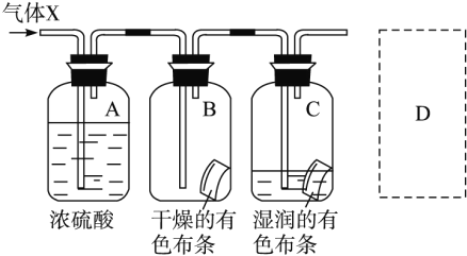
①该项研究(实验)的主要目的是_________________________________________。
②与研究目的直接相关的实验现象是_____________。
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是__________。
④请在图中的D处以图的形式表明克服事故隐患的措施。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由 .
(3)完成以下氧化还原反应的离子方程式:MnO﹣4+C2O2﹣4+=Mn2++CO2↑+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去.常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀. 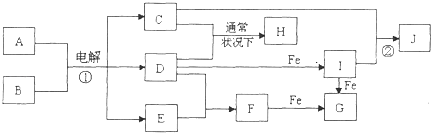
(1)H的化学式为 .
(2)F的电子式为 .
(3)反应①的化学方程式为 .
(4)反应②的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种名样,如图是扇形元素周期表的一部分,下列说法正确的是
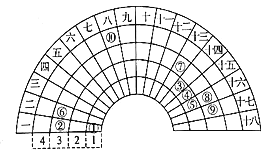
A. 简单氢化物的沸点: ④>⑤>⑨
B. 该表中标注的元素⑩处于第四周期ⅦB族
C. 元素⑥和⑦的原子序数相差11
D. 同温同压下,等质量的由元素⑤形成的两种气体单质含有相同的原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液,能在强酸性或强碱性中都能大量共存且无色的离子组是
A. Cu2+、K+、CO32-、NH4+ B. Ba2-、Na+、SO42-、NO3-
C. Na+、H+、HCO3-、Cl- D. K+、Na+、NO3-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com