
下列各组离子,在强碱性溶液中可以大量共存的是( )
|
| A. | K+HCO3﹣NO3﹣ClO﹣ | B. | Na+SO32﹣NH4+Ba2+ |
|
| C. | Ba2+ HS﹣Cl﹣SO42﹣ | D. | AlO2﹣CO32﹣Cl﹣Na+ |
考点:
离子共存问题.
分析:
强碱性溶液中存在大量氢氧根离子,
A.碳酸氢根离子与氢氧根离子反应;
B.钡离子与亚硫酸根离子反应生成亚硫酸钡沉淀,铵根离子与强碱性溶液中的氢氧根离子反应;
C.钡离子与硫酸根离子反应生成硫酸钡沉淀,硫氢根离子与氢氧根离子反应;
D.四种离子之间不发生反应,都不与氢氧根离子反应.
解答:
解:A.HCO3﹣与强碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.SO32﹣、Ba2+之间反应生成沉淀,NH4+与强碱性溶液反应,在溶液中不能大量共存,故B错误;
C.Ba2+、SO42﹣之间反应生成硫酸钡沉淀,HS﹣与强碱性溶液反应,在溶液中不能大量共存,故C错误;
D.Al2﹣、CO32﹣、Cl﹣、Na+之间不发生反应,都不与强碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评:
本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN﹣)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
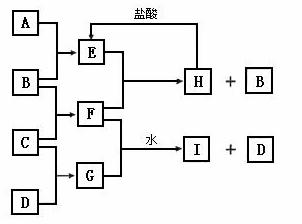
请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液的反应生成I和D的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从Cu、O2、NaOH、盐酸、CaCO3、NaNO3、CaO、AgNO3八种物质中选出合适的,按要求各写出一个方程式.
(1)化合反应 (化学方程式)
(2)分解反应 (化学方程式)
(3)置换反应 (离子方程式)
(4)有气体放出的复分解反应 (离子方程式)
(5)有沉淀生成的复分解反应 (离子方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,某些建筑材料会产生放射性同位素氡 ,从而对人体产生伤害,该同位素原子的中子数和质子数之差是( )
,从而对人体产生伤害,该同位素原子的中子数和质子数之差是( )
|
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
|
| A. | 碳酸钙和醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O |
|
| B. | 氢氧化镁与硫酸溶液反应 H++OH﹣=H2O |
|
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ |
|
| D. | 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钠俗名纯碱或苏打,在外观上与食盐相似,可以作家用洗涤剂,如清洗厨房用具的油污等.下列不能将加碘食盐和碳酸钠区别开的试剂或用品是( )
|
| A. | 食醋 | B. | 淀粉 | C. | pH试纸 | D. | 酚酞试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
若1mol 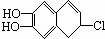 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
|
| A. | 1mol、2mol | B. | 2mol、3mol | C. | 3mol、2mol | D. | 3mol、3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
人造地球卫星用到的一种高能电池﹣﹣银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液.放电时,该电池的电极反应式为:Zn+2OH﹣﹣2e﹣═Zn(OH)2,Ag2O+H2O+2e﹣═2Ag+2OH﹣.下列说法中正确的是( )
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH﹣浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
A. ① B. ①②④ C. ①②③ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com