
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高化合价 | | +2 | +1 | +5 | +7 | +1 | +5 |
| 最低化合物 | -2 | | | -3 | -1 | | -3 |
科目:高中化学 来源:不详 题型:单选题
| A.金属元素的最外层电子数不一定小于4 |
| B.1A族元素形成的单质的熔点随原子序数的递增而降低 |
| C.同主族第三、第四周期的元素原子序数之差不一定等于18 |
| D.单质磷的化学性质比氮气活泼,容易与非金属等物质反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (未完成)。
(未完成)。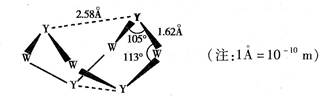
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金、银、铜、铁、钠五种金属元素中,只有钠属于主族元素 |
| B.元素周期表中的所有副族元素都是金属元素,副族包含过渡元素和Ⅷ族 |
| C.元素周期表第8、9、10三列合称Ⅷ族,Ⅷ族是元素周期表所有族中元素种类最多的族 |
| D.O、S、Na、K的原子半径依次增大;KOH、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X2YZ3 | B.X2YZ2 | C.XYZ2 | D.XYZ3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。
。 为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X Y(填“>”、“=”或“<”)
为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X Y(填“>”、“=”或“<”)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com