
环保部制定的《环境空气质量标准》第二次公开征求意见结束,大家普遍赞成将PM2.5(PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物)纳入常规空气质量评价,下列有关PM2.5说法不正确的是
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成气溶胶
C.实施绿化工程,可以有效地防治PM2.5污染
D.研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染
科目:高中化学 来源: 题型:
下表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量N aX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入Na2Z,沉淀又转化为Ag2Z。则表中a、b、c的大小关系为( )
aX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入Na2Z,沉淀又转化为Ag2Z。则表中a、b、c的大小关系为( )
| 相关化合物 | AgX | AgY | Ag2Z |
| pKsp | a | b | c |
A.a>b>c B.a<b<c
C.c<a<b D.a+b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料的研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为____________。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加入NH4F,发生如下反应:Fe(SCN)3+6NH4F===(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外,还有__________(选填序号)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN-中各原子的最外层均满足8电子的稳定结构,则C原子的杂化方式为________,该原子团中σ键与π键的个数比为__________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,
而FeF3晶体的熔点高于1000 ℃。试解释这两种化合物熔点差异较大的原因:____________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图K346所示,则Y轴可表示的氢化物(RH3)性质可能有__________。
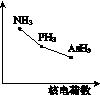
图K346
a.稳定性 b.沸点
c.R—H键能 d.分子间作用力

图K347
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞(结构如图K347所示)顶点的氮原子。据此分析,这种碳氮化钛化合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是
A.Cu(OH)2难溶于水,属于非电解质
B.SO2能与碱反应生成盐和水,属于酸性氧化物
C.NH4Cl组成中不含金属离子,不属于盐
D.HCl气体溶于水电离成H+和Cl-,属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
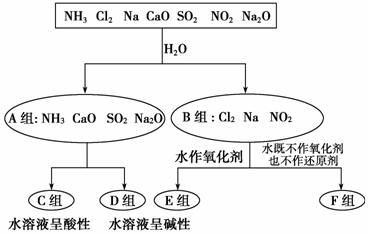
(1)上述第一级分类标准(分成A、B组的依据)是____________________________________________________________________
_________________________________________________________。
(2)F组中物质除了Cl2外,还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:________________________________________________________________。
(4)由Al3+制备Al(OH)3最好不选择D组中的NaOH溶液,说明理由:____________________ _________________________________________。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材 料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li +2H2O===2LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
1)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有离子交换膜【阴(阳)离子交换膜只允许阴(阳)离子通过】,其工作原理如图所示。

①该电解槽的阳极反应式是 。
②图中a、b两处分别加入的物质是 、 ;离子交换膜为 (填“阴”或“阳”)离子交换膜。
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(2)海洋资源的开发与利用具有广阔的前景,海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
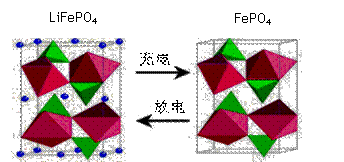
该电池电解质为能传导 Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),电极反应式为 。
(3)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下空气和氯气的体积比为___________________(空气中氧气的体积分数按20%计)。
(4)海水中也含有大量的镁元素,高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如下图,该电池反应的总离子方程式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com