
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
| A、简单离子的半径大小顺序为:W>Q>Z>Y |
| B、Z单质在氧气中燃烧后的产物不能使品红溶液褪色 |
| C、单质熔点高低的顺序为:Z>Y>X |
| D、Z与W元素只能形成原子个数比为2:1的化合物 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(解析版) 题型:填空题
(1)下列是A、B、C、D、E五种短周期元素的某些性质。
ABCDE
化合价-4-2-1-2-1
电负性2.52.53.03.54.0
①E原子的核外电子排布式为________;
②上表中的元素可以组成分子式为ADC2的物质,该物质中所有原子最外层均满足8电子稳定结构。则该分子的结构简式为________;中心原子的杂化方式为________;
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为________;
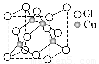
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三11月抽测测试理综化学试卷(解析版) 题型:选择题
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
|
元素代号 |
X |
W |
Y |
Z |
Q |
|
原子半径(×10-12 m) |
37 |
64 |
66 |
70 |
154 |
|
主要化合价 |
+1 |
-1 |
-2 |
+5、-3 |
+1 |
下列说法正确的是
A.由Q与Y形成的化合物中只存在离子键
Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价
查看答案和解析>>
科目:高中化学 来源:0110 模拟题 题型:填空题

 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com