
下列各组离子一定能大量共存的是( )
A.25℃,由水电离出的c(H+)=10-11mol/L的溶液:Na+、K+、Cl-、ClO-
B.与Al反应能放出氢气的溶液:Na+、Ba2+、NO3-、Cl-
C.甲基橙变红的溶液:Na+、Mg2+、SO42-、Cl-
D.含Al3+的溶液:K+、Ca2+、Cl-、S2-
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.32g O2中含有32NA个电子
B.22.4L N2含有阿伏加德罗常数个氮分子
C.在标准状况下,22.4L水的质量约为18g
D.常温常压下22g的CO2与标准状况下11.2L HCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
取1.43g Na2CO3·xH2O溶于水配成100ml溶液,取1.43g Na2CO3·xH2O晶体加热灼烧至恒重后质量为0.530 g求:x= (要求写出计算过程)(1)Na2CO3物质的量浓度;(2)Na+ 物质的量浓度; (3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
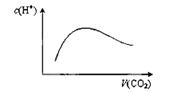
常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的( )
A.当a=2b时,随着CO2气体的通入,
溶液中由水电离出的c(H+)有如上图变化关系
B.当a=b时,所得溶液中存在:
c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D.当1/2<a/b<1时,所得溶液中一定存在: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
⑴写出滴定过程中发生反应的离子方程式为 。
⑵滴定过程中操作滴定管的图示正确的是 。

⑶若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究
b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 |
| 体积(mL) | 浓度 (mol•L-1) | |||
| 1 | 25 | 0.5 | 4 | 0.1000 |
| 2 | 50 | 0.5 | 4 | 0.1000 |
| 3 | 25 | 0.5 | 4 | 0.0100 |
| 4 | 25 | 0 | 4 | 0.1000 |
⑷写出表中a 对应的实验目的 ;
⑸该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)
为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知溶质质量分数为98%的浓硫酸,其物质的量浓度为18.4mol/L,取10mL该硫酸与a mL水混合,配制成溶质质量分数为49%的硫酸,其物质的量浓度为bmol/L,则a,b分别为( )
A.a = 10 b = 9.2 B.a < 10 b > 9.2
C.a > 10 b = 9.2 D.a > 10 b < 9.2
查看答案和解析>>
科目:高中化学 来源: 题型:
I.X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物,则X的化学式为_____________。
(2)若X为单质,写出其与NaOH溶液反应的化学方程式_____________。
(3)若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
常温下X与足量稀氢氧化钠溶液反应的离子方程式为_____________。
II. 在一定条件下进行的下列化学反应,请根据以下的转化关系回答下列问题。已知A、B、C中均含有同种元素。
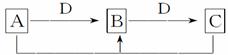
(1)若D为金属单质,且以上反应均为氧化还原反应,转化过程中没有除A、B、C外的其他物质生成,请写出A+C→B反应的离子方程式__________。
(2)在常温下,若B、D为非金属单质,A是有臭鸡蛋气味的气体,请写出A+C→B反应的化学方程式__________。
(3)若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A________,B________,C________,D________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(1)写出元素⑨的基态原子的价电子排布式________,元素⑩的原子结构示意图___________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一种反应的化学方程式__ 。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中最简单原子数最少的
一种是室内装潢时形成的主要气体污染物。试写出它的电子式_ ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为__ 。
(3)元素④的氢化物的分子立体构型为_________,中心原子的杂化方式______。
③④⑤三种元素的第一电离能大小关系是_____ ____(填元素符号)、电负性大小关系是 _________ (填元素符号)。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与盐酸溶液反应的化学方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程能使蛋白质变性的是K( )
|
| A. | 蛋白质中加Na2SO4后析出蛋白质 |
|
| B. | 蛋白质用福尔马林浸泡 |
|
| C. | 蛋白质中加Pb(Ac)2后析出蛋白质固体 |
|
| D. | 蛋白质中遇X光后 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com