
已知W、X、Y、Z是短周期元素,aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列说法正确的是
| A.离子的还原性:Y2-> Z- |
| B.原子半径:r(W) > r(X) |
| C.质子数:c>a |
| D.W和X两者最高价氧化物对应的水化物能相互反应 |
A
解析试题分析:依题意推断,四种离子具有28电子层结构,aW2+、bX+、cY2-、dZ-分别为12Mg2+、11Na+、8O2-、9F-,则W、X、Y、Z分别为Mg、Na、O、F;非金属性:O<F,则单质的氧化性:O2<F2,由氧化还原反应规律可知,还原性:8O2->9F-,故A正确;原子半径:Na>Mg,离子半径:Na+> Mg2+,故B错误;c=8,a=12,8<12,则c<a,故C错误;氢氧化镁是中强碱,不是两性氢氧化物,氢氧化钠是强碱,二者不能反应,故D错误。
考点:考查元素周期表和元素周期律,涉及非金属性、单质氧化性、简单阴离子的还原性的比较,原子半径、质子数、最高价氧化物对应水化物的性质等。


科目:高中化学 来源: 题型:单选题
下列说法中,正确的是
| A.酸性:盐酸>氢硫酸,则得电子能力:Cl>S |
| B.第二周期元素的最高正化合价从左到右依次升高 |
| C.元素原子的最外层电子数越多,其氢化物稳定性越强 |
| D.共价化合物中只存在共价键,离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知W.X.Y.Z为短周期元素,W.Z同主族,X.Y.Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X.Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
| A.W与X形成的化合物中只含离子键 |
| B.X、Y、Z、W的原子半径依次减小 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B、C、D、E是短周期元素,原子序数依次增大。其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的合金是日常生活中常用的金属材料。下列说法正确的是
A.B位于元素周期表中第二周期第VIA族
B.工业上常用电解法制备C、D、E的单质
C.C、D的最高价氧化物对应的水化物之间能发生化学反应
D.化合物AE与CE具有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族,则
| A.原子半径:Y< Z < W |
| B.单质的还原性:Y> Z |
| C.气态氢化物的稳定性:X>W |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
aXn-和 bYm+为两种主族元素的离子,它们的核外电子排布相同,下列判断中正确的是( )
| A.原子序数:X>Y | B.a -n = b+m |
| C.离子半径:Xn-> Ym+ | D.原子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知某短周期元素原子的第三电子层上排布有5个电子,则该元素在周期表中的位置是( )
| A.第二周期第IVA族 | B.第二周期第VA族 |
| C.第三周期第IVA族 | D.第三周期第VA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是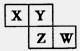
| A.X、Y、Z的原子半径大小:X>Y>Z |
| B.X、W的气态氢化物能相互反应,生成共价化合物 |
| C.Z、W的最高价氧化物对应水化物的酸性,前者更强 |
| D.Y的单质与氢气反应较Z剧烈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com