
【题目】已知H+(aq) + OH—(aq) = H2O(l) △H1 = -57.3 kJ·mol—1 CH3COO-(aq) + H2O![]() CH3COOH(aq) + OH-(aq) ΔH2 =aKJ/mol,下列说法正确的是:
CH3COOH(aq) + OH-(aq) ΔH2 =aKJ/mol,下列说法正确的是:
A. a = 57.3
B. a > 57.3
C. 0<a<57.3
D. 增大c(CH3COO-),a值增大
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g) +2H2(g) ![]() CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
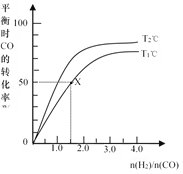
A. T1<T2
B. T1℃时该反应的平衡常数为4.0 L2·mol-2
C. 同一温度下,n(H2)/n(CO)越大,平衡常数也越大
D. 同条件下n(H2)/n(CO)越大,CO和H2的转化率也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是:
A. 1L0.1 mol·L-1NaHCO3溶液中含有0.1 NA个HCO3-
B. 0.1 mol Cl2参加化学反应,转移电子数目一定为0.2 NA
C. 常温常压下,28g N2和CO混合气体中含有原子总数为2NA
D. 足量Na与1 molO2加热反应,转移电子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 27.45 |
第二次 | 25.00 | 0.00 | 30.30 |
第三次 | 25.00 | 0.00 | 27.55 |
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应N2O4(g)![]() 2NO2(g) ΔH>0,平衡体系中总质量(m总)与总物质的量(n总)之比M(M=
2NO2(g) ΔH>0,平衡体系中总质量(m总)与总物质的量(n总)之比M(M=![]() )在同温度下随压强的变化曲线如图所示。下列说法正确的是:
)在同温度下随压强的变化曲线如图所示。下列说法正确的是:
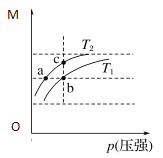
A. 温度:T1<T2
B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:vb<va
D. 当M=69 g·mol-1时,n(NO2)∶n(N2O4)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法中正确的是( )
A.服用铬含量超标的药用胶囊会对人体健康造成危害
B.酒精可以使蛋白质变性,酒精纯度越高杀菌消毒效果越好
C.食品袋中放置的CaO可直接防止食品氧化变质
D.“酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)相同物质的量的O2和O3的质量比 , 分子个数比为 , 所含氧原子的个数比为 .
(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为g.此溶液中Mg2+的物质的量浓度为mol/L,Cl﹣的物质的量浓度为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com