
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )。
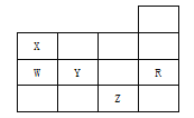
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. Y的氢化物的沸点比H2O的沸点高
D. Y元素的非金属性比W元素的非金属性强
科目:高中化学 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

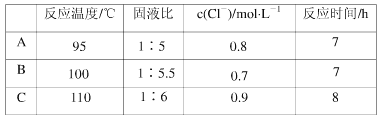
反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行反应:X2(g)+3Y2(g) ![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡后,各物质的浓度有可能是
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡后,各物质的浓度有可能是
A.X2为0.2 mol·L-1 B.Y2为0.1 mol·L-1
C.Z2为0.4mol·L-1 D.Y2为0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中元素和化合物的描述,正确的是( )
A. C是活细胞中含量最多的元素,是生命的核心元素
B. 蛋白质是活细胞中含量最多的有机物,是生命活动的重要物质
C. RNA分子携带大量的遗传信息,是主要的遗传物质
D. 糖原分子中贮存大量能量,是生命活动的直接能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于维生素C的下列说法中不正确的是
A. 易溶于水,水溶液显酸性
B. 受热易分解
C. 在水溶液中容易被还原
D. 新鲜的水果和蔬菜中含有维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4![]() 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3![]() 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol某链烃最多能和2 mol HCl发生加成反应,生成1 mol 氯代烷,1 mol该氯代烷能和6 mol Cl2发生取代反应,生成只含碳元素和氯元素的氯代烃,该烃可能是
A.CH3CH=CH2B.CH3C≡CH
C.CH3CH2C≡CHD.CH2=CHCH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A分子式为C5H10O2 , 且能与NaHCO3溶液反应产生气体,则A的同分异构体数目共有(不考虑立体结构)( )
A.2种
B.3种
C.4种
D.5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com