
【题目】某研究小组利用废弃的铁铝混合物(含Fe、Al、Al2O3、Fe2O3)回收金属铝和铁,实验流程设计如下:
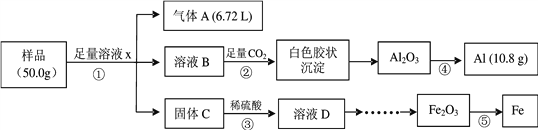
(1)写出①中发生反应的离子方程式___________、_____________。
(2)下列说法正确的是_________。
a. ②中发生的是非氧化还原反应
b. ③中所得溶液D中含有Fe2+和Fe3+
c. ④和⑤分别采用电解法和热还原法
(3)由溶液D制取Fe2O3的实验过程是 ______________。
(4)该样品中Al2O3的质量分数是_____________。
【答案】 2Al + 2OH- + 2 H2O = 2AlO2- +3H2↑ Al2O3 + 2OH- =2AlO2- + H2O abc 加入过量的氢氧化钠溶液,过滤,加热 20.4%
【解析】从实验流程可知,样品需加氢氧化钠溶液溶解Al和Al2O3,实现和Fe和Fe2O3的分离,则溶液x为氢氧化钠溶液,反应①为Al和氢氧化钠溶液反应生成偏铝酸钠和氢气,以及Al2O3和氢氧化钠溶液反应生成偏铝酸钠和水;溶液B为偏铝酸钠溶液,固体C为Fe和Fe2O3的混合物,反应②为偏铝酸钠溶液通入足量的二氧化碳,生成氢氧化铝沉淀,反应③为Fe和Fe2O3分别和稀硫酸反应所得D溶液中含有Fe2+和Fe3+,反应④为电解熔融Al2O3制取Al,反应⑤为热还原法炼铁的反应,以此分析。
结合以上分析,(1)写出①中发生反应的离子方程式2Al + 2OH- + 2H2O = 2AlO2- +3H2↑ 、Al2O3 + 2OH- =2AlO2- + H2O;
(2)a. ②中发生NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3,属于非氧化还原反应,a正确;
b. ③中反应为Fe+H2SO4==FeSO4+H2↑、Fe2O3+ 3H2SO4==Fe2(SO4)3+3H2O,因此所得溶液D中含有Fe2+和Fe3+,b正确;c. 反应④是电解熔融Al2O3制取Al,反应⑤为热还原法炼铁的反应,故c正确;因此本题答案为:abc。
(3)由溶液D含有Fe2+和Fe3+,向溶液D中加入过量的氢氧化钠溶液,过滤,可转化为氢氧化铁沉淀,加热氢氧化铁分解生成Fe2O3。因此本题答案为:加入过量的氢氧化钠溶液,过滤,加热。
(4)从实验流程知,最终得到Al为10.8g;根据反应①中2Al + 2OH- + 2H2O = 2AlO2- +3H2↑,样品中的Al的质量为:![]() ×
×![]() ×27g/mol=5.4g;则样品中含Al2O3的质量为(10.8g-5.4g)×
×27g/mol=5.4g;则样品中含Al2O3的质量为(10.8g-5.4g)×![]() =10.2g,所以该样品中Al2O3的质量分数是
=10.2g,所以该样品中Al2O3的质量分数是![]() ×100%=20.4%。
×100%=20.4%。
因此本题答案为:20.4%。


科目:高中化学 来源: 题型:
【题目】铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
I、铁矿石中含氧量的测定
①按下图组装仪器,检查装置的气密性;
②将 10.0g 铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地通入 H2,______,点燃 A 处酒精灯;
④……
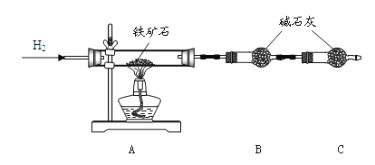
(1)装置 C 的作用为_______________________________________ 。
(2)将步骤③的操作补充完整:_________。
(3)实验结束后的操作包括: a.冷却至室温 b.熄灭 A 处的酒精灯 c.停止通 H2。正确的顺序为:_________(填序号)。
(4)实验测得反应后装置 B增重 2.7g,据此可以测出铁矿石中氧的含量。有同学认为,不测定 B 装置的净增质量,通过测定_________,也能达到实验目的。
II、铁矿石中含铁量的测定
将上述实验结束后硬质玻璃管中的固体全部取出,用足量稀硫酸浸取后过滤。向滤液中通入足量Cl2 并加热煮沸得溶液 M,冷却后将溶液 M 稀释至 250mL。取 20.00mL M 的稀溶液,用 0.5000mol·L-1的标准 KI 溶液与其反应,消耗 KI 溶液 20.00 mL。
(5)向滤液中通入足量 Cl2 的目的是将其中的 Fe2+氧化成 Fe3+。将通入 Cl2 后的溶液加热煮沸的目的则是_________。 若省去该操作,则所测铁的百分含量将_________。(填“偏大”, “偏小”或“无影响”)。
(6)标准 KI 溶液与 M 稀溶液发生反应的离子方程式为:_________。
III、化学式的确定
(7)结合 I、 II 的实验数据计算该铁矿石中铁的氧化物的化学式为_________。 (请化成最简单的整数比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生下图所示一系列变化,则下列说法错误的是
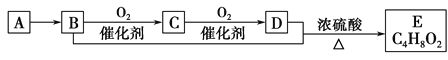
A. A分子中所有原子均在同一平面内
B. C4H8O2含酯基的同分异构体有4种
C. C的水溶液又称福尔马林,具有杀菌、防腐性能
D. 等物质的量的B、D与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见化学物质的应用不正确的是( )
A.干冰能用作冷冻剂
B.明矾可用作净水剂
C.味精可用作食品调味剂
D.苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
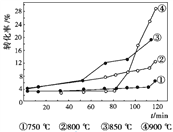
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
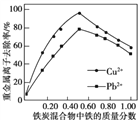
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应,转化关系中有些反应的产物和反应的条件没有全部标出。
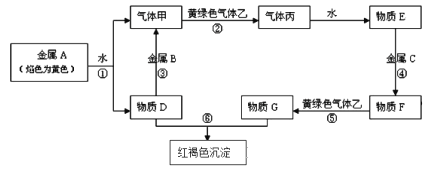
请根据以上信息回答下列问题:
(1)写出金属元素A在周期表中的位置:____________,物质D的电子式:____________。
(2)写出下列反应的离子方程式:反应③__________________________________;
反应⑤_______________________________________。
(3)检验物质G中阳离子的操作方法 ________________________________________。
(4)实验室制取黄绿色气体乙的化学方程式为 _________________________________,在该反应中如有0.5mol乙生成,转移电子的物质的量是______mol,制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A蒸气的密度是相同状况下氢气密度的36倍,已知该烃中的碳氢元素质量比为5:1,求:
(1)该烃的相对分子质量为______;
(2)确定该烃的分子式为______;
(3)该烃的同分异构体有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH3CH3+Cl2 ![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
B.CH2═CH2+HBr→CH3CH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH ![]() H3COOCH2CH3+H2O
H3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的SO2与1.25molO2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0 。30s气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
2SO3(g)△H<0 。30s气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
A. 达到平衡时,气体的密度是反应前的80%
B. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为209.7g
C. 该温度下的平衡常数为101.25L/moL
D. 0~30s时SO3生成速率为3.0×10-2mol/(L.s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com