
【题目】法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为 “零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性B.该粒子质量数为 4
C.在周期表中与氢元素占同一位置D.该粒子质量比氢原子大
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,草酸铜晶体(CuC2O4· xH2O)受热分解的化学方程式为: CuC2O4· xH2O·![]() CuO+CO↑ +CO2↑ +xH2O↑。某化学兴趣小组设计如图装置,探究草酸铜晶体分解的气体产物:
CuO+CO↑ +CO2↑ +xH2O↑。某化学兴趣小组设计如图装置,探究草酸铜晶体分解的气体产物:
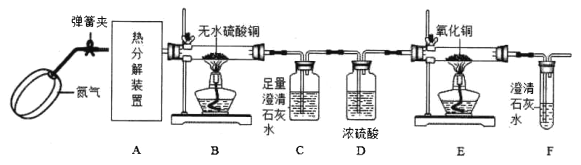
请回答:
(1)该套实验装置的明显缺陷是________。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中________ (填实验现象),则可证明草酸铜晶体热分解的气体产物是H2O、CO、CO2。
(3)该兴趣小组改变热分解反应条件,完全反应后发现C中白色沉淀量明显较先前实验多,而E、F中未见明显现象,请推测A装置中固体产物成分并设计一个实验方案,用化学方法验证固体产物________ (不考虑操作和药品的问题)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1.06g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3溶液的物质的量浓度;________________
(2)Na+ 物质的量浓度; ______________
(3)取出20.0ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求稀释后溶液的体积。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)![]() CH3OCH3(g+3H2(g) △H
CH3OCH3(g+3H2(g) △H
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7kJ.mol-l
CH3OH(g) △H1=-90.7kJ.mol-l
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ.mol-l
CO2(g)+H2(g) △H2=-41.2kJ.mol-l
(1)△H_____ kJ.mol-l
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P前/P后) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则达到平衡时CO的转化率为_________。
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示。从图中可得出三条主要规律:
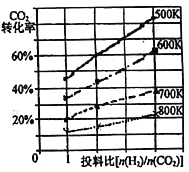
①增大投料比,CO2的转化率增大;②_____________;③_______________。
(4)反应③的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。
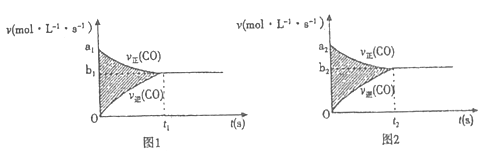
下列说法正确的是________。
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦ t1<t2 ⑧两图中阴影部分面积相等⑨右图阴影部分面积更大 ⑩左图阴影部分面积更大
A. ①③⑦⑧ B. ①③⑤⑧ C. ②④⑦⑨ D. ①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:____________。与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,乙装置中充入滴有酚酞的氯化钠溶液,X、Y均为石墨电极。反应一段时间后,乙装置X极附近溶液先变红。下列判断中正确的是
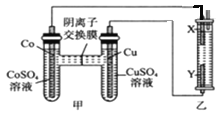
A. 电子流向:Cu电极→Y→X→Co电极
B. 钴(Co)的金属性比铜的强
C. 工作时,SO42-向Cu电极移动
D. 转移0.2mol e-,乙中生成0.2molNaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1
CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
③催化液化Ⅱ:CO2(g)+2H2(g)![]() CH3OH(g)+1/2O2(g) ΔH3=a kJ·mol-1
CH3OH(g)+1/2O2(g) ΔH3=a kJ·mol-1

A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、ΔH2都减小
B. 反应C(s)+H2O(g)+H2(g)![]() CH3OH(g) ΔH=+41.1 kJ·mol-1
CH3OH(g) ΔH=+41.1 kJ·mol-1
C. ΔH2>ΔH3
D. 如图为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+6OH-![]() CO2↑+5H2O
CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中I是一种高分子化合物,其合成路线如图:


已知:①![]()
②回答下列问题:
(1)A的名称为_______(系统命名法),G含有的官能团_____(写名称)。
(2)反应①的反应类型是________.
(3)I的结构简式为_____________________________;
(4)反应②的化学方程式为__________________________________。
(5)符合下列条件的G的同分异构体共有___________种。
①与G具有相同官能团; ②属于芳香族化合物
(6)参照上述合成路线,设计一条由乙醛、甲醇和J(E的同系物且相对分子质量比E小14)为主要原料(无机试剂任选)制备![]() 的合成路线______________。
的合成路线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A.PVC(聚氯乙烯)包装袋不能用于食品包装
B.能生成有机高分子化合物的反应只有加聚反应
C.糖尿病人应少吃含糖的食品,即使是未加糖的八宝粥也要慎重食用
D.塑料、合成橡胶和合成纤维称为三大合成材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com