
取10 g软锰矿(主要成分为MnO2)跟足量的浓盐酸在加热条件下充分反应,收集到氯气7.1 g。
(1)写出反应的化学方程式;
(2)求该软锰矿中MnO2的质量分数;
(3)被氧化的HCl的物质的量。
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
(1)写出反应的化学方程式;
(2)求该软锰矿中MnO2的质量分数;
(3)被氧化的HCl的物质的量。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省徐州市高三模底考试化学试卷(带解析) 题型:填空题
(12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是 。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是 。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0.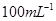 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
g.
②取上述制得的KMnO4产品0.316g,酸化后用 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: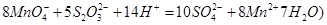
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省毕业班阶段性测试二化学试卷(解析版) 题型:填空题
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示:
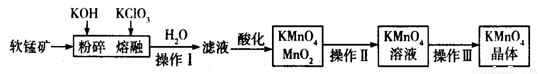
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
A.盐酸 B.稀硫酸 C.硝酸 D.氢硫酸
(2)操作Ⅰ、Ⅱ、Ⅲ的名称分别是______________、_______________、_______________。
(3)软锰矿与过量固体KOH和KClO3在熔融状态下反应时的氧化剂是__________________(填化学式)。反应后加水溶解得到的滤液中主要含有KCl和K2MnO4,则滤液酸化时发生反应的离子方程式为 _______________________________。
(4)已知KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2。取上述制得的KMnO4产品0.33 g,恰好与0.67 g Na2C2O4完全反应,则KMnO4的纯度为________%。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三模底考试化学试卷(解析版) 题型:填空题
(12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是 。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是 。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0.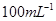 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
g.
②取上述制得的KMnO4产品0.316g,酸化后用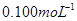 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: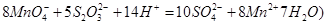
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com