


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ||
| ||
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
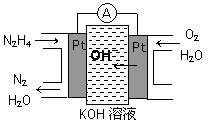
��1����ȼ�ϵ��ԭ����ͼ��ʾ����ߵ缫�Ϸ����ĵ缫��ӦʽΪ_________��
��2���������N2O4��������������ȼ�ϣ���֪��

N2(g)��2O2(g)��2NO2(g) ��H ����67.7kJ��mol-1
N2H4(g)��O2(g)��N2(g)��2H2O(g) ��H ����534.0kJ��mol-1
2NO2(g)![]() N2O4(g) ��H ����52.7kJ��mol-1
N2O4(g) ��H ����52.7kJ��mol-1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ��________��
��3�������Ĺ�ҵ�������ð��ʹ�������Ϊԭ�ϻ�ã�д����Ӧ�����ӷ���ʽΪ_ __��
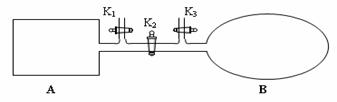
��4����ͼ��ʾ��A�������Ȳ����Ƴɵ����������ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ�����ɱ�������ң�����ı���������嵯���ı���Բ��ƣ����ر�K2������1 mol NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱA��B�������ͬ��Ϊa L��

��B�п�ͨ��________________�жϿ��淴Ӧ2NO2![]() N2O4�Ѿ��ﵽƽ�⡣
N2O4�Ѿ��ﵽƽ�⡣
������K2��ƽ���B�������������0.4a L�����K2֮ǰ������B���Ϊ______L��
��������A�е���ƽ������ʱ��t s���ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������ ƽ����ѧ��Ӧ����v(NO2)����____________________(�ú�a��t�Ĵ���ʽ��ʾ)��
����ƽ�����A�������ٳ���0.5mol NO2�������µ���ƽ���ƽ��������NO2���������_______________���� �������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
��1����ȼ�ϵ��ԭ����ͼ��ʾ����ߵ缫�Ϸ����ĵ缫��ӦʽΪ_________��
��2���������N2O4��������������ȼ�ϣ���֪��
N2(g)��2O2(g)��2NO2(g) ��H ����67.7kJ��mol-1
N2H4(g)��O2(g)��N2(g)��2H2O(g) ��H ����534.0kJ��mol-1
2NO2(g)![]() N2O4(g) ��H ����52.7kJ��mol-1
N2O4(g) ��H ����52.7kJ��mol-1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ��________��
��3�������Ĺ�ҵ�������ð��ʹ�������Ϊԭ�ϻ�ã�д����Ӧ�����ӷ���ʽΪ_ __��
��4����ͼ��ʾ��A�������Ȳ����Ƴɵ����������ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ�����ɱ�������ң�����ı���������嵯���ı���Բ��ƣ����ر�K2������1 mol NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱA��B�������ͬ��Ϊa L��
��B�п�ͨ��________________�жϿ��淴Ӧ2NO2![]() N2O4�Ѿ��ﵽƽ�⡣
N2O4�Ѿ��ﵽƽ�⡣
������K2��ƽ���B�������������0.4a L�����K2֮ǰ������B���Ϊ______L��
��������A�е���ƽ������ʱ��t s���ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������ ƽ����ѧ��Ӧ����v(NO2)����____________________(�ú�a��t�Ĵ���ʽ��ʾ)��
����ƽ�����A�������ٳ���0.5mol NO2�������µ���ƽ���ƽ��������NO2���������_______________���� �������С�����䡱����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com