
设NA为阿伏伽德罗常数的值,下列说法正确的是()
A. 7.8g Na2O2中离子总数为0.4NA
B. 标准状况下,11.2L CCl4中的分子数为0.5NA
C. 常温常压下,48g O2和O3的混合气体中含有的氧原子数为3NA
D. 2.7g金属铝变为铝离子时失去的电子数为0.1NA
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子;
B.标况下,四氯化碳不是气体,不能使用标况下的气体摩尔体积计算其物质的量;
C.48g臭氧和氧气中含有48g氧原子,含有3mol氧原子;
D.铝为3价金属,2.7g铝的物质的量为0.1mol,变成铝离子时失去0.3mol电子.
解答: 解:A.过氧化钠中阴离子为过氧根离子,7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,离子总数为0.3NA,故A错误;
B.标况下四氯化碳不是气体,题中条件无法计算四氯化碳的物质的量,故B错误;
C.48g氧气和臭氧的混合物中含有48gO原子,含有氧原子的物质的量为3mol,含有的氧原子数为3NA,故C正确;
D.2.7g铝的物质的量为0.1mol,0.1mol铝变成铝离子失去0.3mol电子,失去的电子数为0.3NA,故D错误;
故选C.
点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下四氯化碳不是气体、过氧化钠中阴离子为过氧根离子.


科目:高中化学 来源: 题型:
在某无色透明的酸性溶液中,能共存的离子组是( )
A. Na+、K+、SO42﹣、HCO3﹣ B. Cu2+、K+、SO42﹣、NO3﹣
C. Na+、K+、Cl﹣、NO3﹣ D. Fe3+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
图表归纳是学习化学的一种常用方法,某同学表中归纳的内容与如图对应正确的是()
选项 x y z
A 胶体 混合物 淀粉溶液
B 化合物 酸性氧化物 一氧化氮
C 纯净物 化合物 液溴
D 强电解质 强酸 硫酸
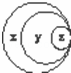
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH.下列有关说法正确的是()
A. Li2NH中N的化合价是﹣1
B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H+的离子半径相等
D. 此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾在不同的条件下发生的反应如下:
MnO4﹣+5e﹣+8H+═Mn2++4H2O①
MnO4﹣+3e﹣+2H2O═MnO2↓+4OH﹣②
MnO4﹣+e﹣═MnO42﹣(溶液绿色)③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的酸碱性影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 ﹣→ +.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
KMnO4+ K2S+ KOH═ K2MnO4+3K2SO4+2S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子检验方法和结论不相符的一组是()
序号 检验方法 结论
A 向一种未知溶液中加入BaCl2溶液,有白色沉淀生成 未知溶液中一定含有SO42﹣
B 向一种未知溶液中滴加KSCN溶液,溶液变为红色 未知溶液中一定含有Fe3+
C 向一种未知溶液中先加入盐酸酸化,再滴加AgNO3溶液,有白色沉淀生成 未知溶液中不一定含有Cl﹣
D 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 不能确定未知溶液中一定含有CO32﹣
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于加成反应的是()
A. CH2=CH2+HBr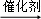 CH3CH2Br
CH3CH2Br
B. 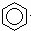 +Br2
+Br2
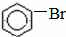 +HBr
+HBr
C. 2CH3CH2OH+O2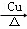 2CH3CHO+2H2O
2CH3CHO+2H2O
D. CH4+2Cl2 CH2Cl2+2HCl
CH2Cl2+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置不能达到实验目的是()
A. 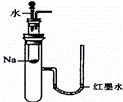
验证Na和水反应是否为放热反应
B. 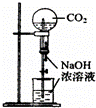
用CO2做喷泉实验
C. 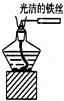
观察纯碱的焰色反应
D. 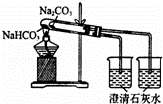
比较Na2CO3、NaHCO3的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用NaNO2+NH4Cl═NaCl+N2↑+2H2O制备N2,下列说法正确的是()
A. NaNO2发生氧化反应
B. NH4Cl中的氮元素被还原
C. N2既是氧化产物,又是还原产物
D. 每生成1mol N2转移电子的物质的量为6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com