
【题目】将浓度为0.1molL﹣1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+)
B.Ka(HF)
C.![]()
D.![]()
【答案】D
【解析】解:A、因HF为弱酸,则浓度为0.1molL﹣1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;
C、因稀释时一段时间电离产生等量的H+和F﹣ , 溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10﹣7molL﹣1 , c(F﹣)不断减小,则比值变小,故C错误;
D、因Ka(HF)= ![]() ,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则
,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则 ![]() 增大,故D正确;
增大,故D正确;
故选:D.
根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.


科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.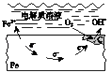
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀
B.
钢铁表面水膜的酸性较强,发生析氢腐蚀
C.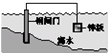
将锌板换成铜板对钢闸门保护效果更好
D.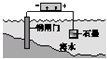
钢闸门作为阴极而受到保护
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw .
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.
①若所得混合溶液为中性,且a=12,b=2,则 Va:Vb=
②若所得混合溶液的pH=10,且a=12,b=2,则 Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东汉成书的《神农本草经》有“石胆化铁为铜”(石胆是硫酸铜)的记载。这一方法开创了人类文明史上湿法冶金的先河。其中涉及的化学反应类型是
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50molL﹣1盐酸与50mL0.55molL﹣1 NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器的名称是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)。
(4)如果用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往100 mL 1 mol·L -1 的AlCl3 溶液中滴加1 mol·L -1 的NaOH溶液,得3.9 g沉淀,则加入NaOH溶液的体积可能是
A. 100 mL B. 200 mL C. 300 mL D. 350 mL
【答案】D
【解析】氯化铝的物质的量是0.1mol,生成的氢氧化铝是3.9g÷78g/mol=0.05mol,如果氯化铝过量,则根据Al3++3OH-===Al(OH)3↓可知需要氢氧化钠是0.15mol,溶液体积是0.15mol÷1mol/L=0.15L=150mL;如果氢氧化钠过量,生成的氢氧化铝部分溶解,则0.1mol氯化铝需要0.3mol氢氧化钠生成0.1mol氢氧化铝,其中有0.05mol氢氧化铝溶解,根据Al(OH)3+OH-===AlO2-+2H2O可知又需要0.05mol氢氧化钠,则溶液体积是0.35mol÷1mol/L=0.35L=350mL,答案选D。
点睛:该题也可以借助图像解答,例如把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量的现象是:先有白色沉淀产生,然后沉淀逐渐溶解,有关反应:A→B:Al3++3OH-===Al(OH)3↓、B→D:Al(OH)3+OH-===AlO2-+2H2O,图像: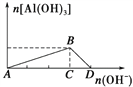 ,作纵坐标的垂线与图像有2个交点(B点除外),因此需要氢氧化钠的物质的量也有两种情况,解答时可以灵活应用。
,作纵坐标的垂线与图像有2个交点(B点除外),因此需要氢氧化钠的物质的量也有两种情况,解答时可以灵活应用。
【题型】单选题
【结束】
11
【题目】某溶液中有Fe3+、Mg2+ 、Fe2+ 和Al3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量增加的阳离子是
A. Fe3+ B. Mg2+ C. Fe2+ D. Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10.0g某有机物在氧气中充分燃烧生成CO2和H2O,将这些燃烧产物与足量Na2O2充分反应,Na2O2能增重10.0g,此有机物不可能是( )
A. C6H12O6 B. C2H5OH C. HCHO D. CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com