
| A、常温常压下,16g甲烷分子所含质子数为10NA |
| B、1 mol Cl2参加反应转移电子数一定为2NA |
| C、标准状况下,22.4L乙醇的分子数为NA |
| D、1 L 0.01 mol的Na2CO3溶液中含有0.01NA个CO32- |


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
| A、稀释溶液,水解平衡常数增大 | ||||||
B、升高温度,
| ||||||
| C、通入CO2,平衡右移动 | ||||||
| D、加入NaOH(s),溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
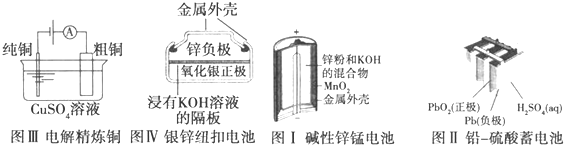
| A、图Ⅰ所示电池中,MnO2作催化剂 |
| B、图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C、图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D、图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:l | B、1:2 |
| C、1:3 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4?7H2O进行消毒、净化,以改善水质 |
| B、铝表面有一层致密的氧化薄膜,故铝制容器可用来腌制咸菜等 |
C、 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: |
| D、借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
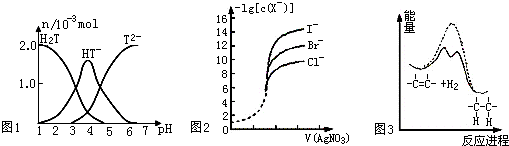
| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com