
A.加入适量NaOH固体 B.加入适量水
C.通入适量SO2 D.加入适量CuSO4固体
科目:高中化学 来源: 题型:
A.加入适量NaOH固体 B.加入适量水?
C.通入适量SO2 D.加入适量CuSO4固体?
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,H2S的饱和溶液1L,浓度约0.1 mol·L-1,其电离方程式第一步为:H2S![]() H++HS-;第二步:HS-
H++HS-;第二步:HS-![]() H++S2-,若使溶液H+、S2-浓度同时减小,可采取的措施是( )
H++S2-,若使溶液H+、S2-浓度同时减小,可采取的措施是( )
A.加入适量NaOH固体 B.加入适量水
C.通入适量SO2 D.加入适量CuSO4固体
查看答案和解析>>
科目:高中化学 来源:0101 期中题 题型:填空题
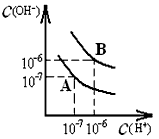
查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
 H++HS-;
H++HS-; H++S2-。若要使该溶液的c(H+)增大的同时,c(S2-)减小,可采用的措施是
H++S2-。若要使该溶液的c(H+)增大的同时,c(S2-)减小,可采用的措施是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com