
【化学—选修2化学与技术】(15分)技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如下图:

(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式)。
(2)沉淀池中发生反应的化学方程式____________ ____,煅烧炉中发生反应的化学方程式是_______________________。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是 ,加入细小食盐颗粒的作用是________________。
(4)写出路布兰制碱法的反应原理中属于氧化还原反应的化学方程式 ,该法与侯德榜制碱法相比的缺点是 (写出两点即可)
(5)候氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中的纯度表达式为: 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015浙江省湖州市高三上学期期末考试化学试卷(解析版) 题型:选择题
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:

下列说法正确的是
A.沉淀甲可能是AgBr
B.沉淀丙一定是BaCO3
C.气体甲的成份只有4种可能
D.肯定存在的离子有AlO2-、S2-、SO32-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高二下学期3月月考化学试卷(解析版) 题型:选择题
对Na、Mg、Al有关性质的叙述正确的是
A.碱性:NaOH<Mg(OH)2<Al(OH)3 B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al D.还原性:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省丽水市高三第一次模拟理综化学试卷(解析版) 题型:填空题
(15分)汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g),请回答下列问题:
N2(g)+2CO2(g),请回答下列问题:
(1)对于气相反应,用某组分B平衡时的分压p(B)代替物质的量浓度c(B)也可表示平衡常数,记作KP,则该反应的平衡常数KP表达式为 ;
(2)已知:N2(g) + O2(g) =2NO(g) △H=+180.5kJ·mol-1
C(s) + O2(g) = CO2(g) △H=-393.5 kJ·mol-1
2C(s) + O2(g) =2CO(g) △H=-221kJ·mol-1
则2NO(g)+2CO(g) N2(g)+2CO2(g)的△H= ,该反应能自发进行的条件 (填“高温”、“低温”或“任意温度”);
N2(g)+2CO2(g)的△H= ,该反应能自发进行的条件 (填“高温”、“低温”或“任意温度”);
(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol。
①若保持体积不变,再向容器中充入n(CO2)= b mol,n(NO)= a mol,则此时v正 v逆(填“>”、“=”或“<”);
②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在下图中补充画出t2-t3-t4时段N2物质的量的变化曲线。

(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。

①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右;
②目前对氮氧化物(NOx)进行治理的方法比较多,其中吸附/吸收法广受欢迎。下列物质适合作为NOx吸收剂的是
A.活性炭 B.氨水 C.酸性尿素溶液 D.硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省丽水市高三第一次模拟理综化学试卷(解析版) 题型:选择题
M、X、Y、Z、W是原子序数依次递增的五种短周期元素,M是所有元素中原子半径最小的,X的一种单质是自然界中硬度最高的物质,Z、W同主族且能形成多种常见化合物。下列叙述正确的是
A.稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物
B.元素X、Y、Z的单质晶体可能属于同种类型的晶体
C.XZ2、X2M2、M2Z2均为直线型的共价化合物
D.由Z和W组成的一种化合物能使酸性高锰酸钾溶液褪色,表明其具有漂白性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古呼伦贝尔市高三高考模拟考(一)理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+)
B.醋酸与醋酸钠的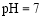 的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+)
的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+)
C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三一模理综化学试卷(解析版) 题型:填空题
(12分)海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

将Br2与Na2CO3反应的化学方程式补充完整:

(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)画出D元素的原子结构示意图 。
C、D、E的简单离子半径由小到大的顺序 ( 用离子符号表示)。
(2)写出元素E在周期表中的位置 。
(3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是 。
(4)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(5)由元素A、B、C按原子个数比4:2:3形成的化合物,写出其电离方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于仪器使用的说法正确的是
A.量筒要准确量取一定体积的液体必须借助胶头滴管定容
B.滴定管量取待测液后要用蒸馏水洗涤滴定管,洗液转入锥形瓶
C.蒸馏时一定要用到蒸馏烧瓶和温度计
D.振荡分液漏斗时应打开其上端玻璃塞并关闭下端活塞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com