
| m |
| M |
| V |
| Vm |
| N |
| NA |
| m |
| M |
| M |
| Vm |
| ||
| ||
| m |
| M |
| m |
| M |
| 1.2g |
| 0.01mol |
| 6.72L |
| 22.4L/mol |
| 3.01��1023 |
| 6.02��1023 |
| 13.6g |
| 34g/mol |
| M |
| Vm |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
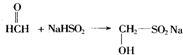 ���ش��������⣺
���ش��������⣺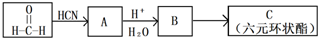
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| �� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��Na+����c��S2-����c��HS-����c��OH-�� |
| B��c��Na+��+c��H+��=c��HS-��+2c��S2-��+c��OH-�� |
| C��c��Na+��=2c��HS-��+2c��S2-��+2c��H2S�� |
| D��c��OH-��=c��H+��+c��HS-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��C��Cl-��+C��OH-��=C��H+��+C��NH4+�� |
| B��2C��Cl-��=C��NH4+��+C��NH3�qH2O�� |
| C��C��NH4+��+2C��H+��=C��NH3�qH2O��+2C��OH-�� |
| D��C��Cl-����C��NH4+����C��H+����C��OH-�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com