
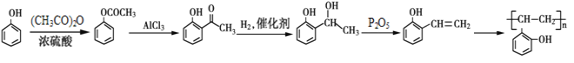
【题目】有机物G是一种药物中间体,合成 G的部分流程如下:
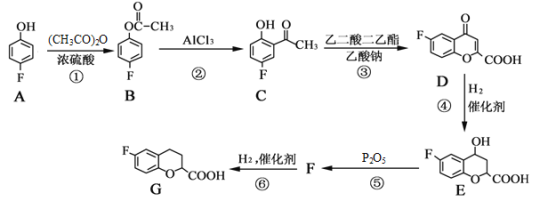
请回答下列问题:
(1)G物质中的含氧官能团的名称是___________、____________。
(2)上述⑤变化过程的反应类型是_____________。
(3)反应A→B的化学方程式为________________________________________。
(4)写出满足下列条件的C的同分异构体的结构简式:_______________________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
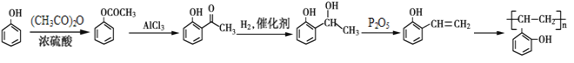
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________
CH3CH2OH__________
【答案】羧基 醚键 消去反应 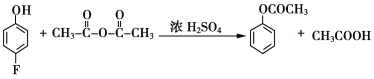
![]()
【解析】
依据合成反应流程图,比较反应物、生成物结构的变化,判断反应类型,书写有关反应的化学方程式;根据要求写出符合题意的同分异构体;应用所学知识、流程中的信息,设计并写出合成反应流程图。
(1)物质G中含氧官能团羧基、醚键。
(2)从E→G,必有消去反应失去羟基,但G中无碳碳双键,又有与氢气加成反应。故反应⑤为消去反应,反应⑥为加成反应(或还原反应)。
(3)比较A、B结构简式可知,A中酚羟基氢被乙酰基(CH3CO-)取代,则反应①的化学方程式为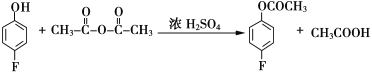 。
。
(4)能与NaHCO3反应生成CO2,则分子中有羧基(-COOH);苯环上的两个取代基可能是-COOH和-CH2F,或-CH2COOH和-F;取代基已有两种不同化学环境的氢原子,则苯环上有两种不同化学环境的氢原子,两种不同取代基应在苯环上对位。符合题意的C的同分异构体为![]() 。
。
(5)由于原料![]() 和乙酸酐可依次发生流程中的反应①②,先后生成
和乙酸酐可依次发生流程中的反应①②,先后生成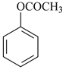 、
、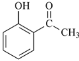 ;目标产物
;目标产物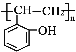 应是
应是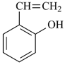 加聚反应生成;
加聚反应生成; 经与氢气加成、再与浓硫酸共热或与P2O5作用脱水可得
经与氢气加成、再与浓硫酸共热或与P2O5作用脱水可得 。故合成路线流程图如下:
。故合成路线流程图如下:


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_______>__________;________比较g、h的最高价氧化物对应水化物的酸性强弱:_______>__________。____________
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:____________________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:
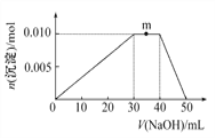
①写出m点反应的离子方程式:____________________________。
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________,其晶体属于____________晶体。
(2)乙的水溶液可以用来做________________________(写出一种用途)。
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为_____。
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式________________________。
甲的制备过程中氨气需要过量的理由是____________________________________。
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于____________(忽略丁的二级电离和H2O的电离)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
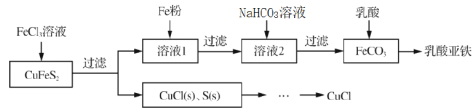
已知:①乳酸亚铁是绿白色晶体,溶于水,几乎不溶于乙醇。
②CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
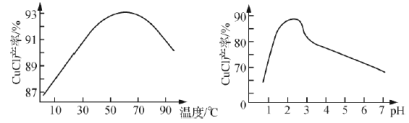
③NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。
(1)FeCl3溶液与黄铜矿发生反应的离子方程式为_______________。
(2)向溶液1中加入过量铁粉的目的是______________。
(3)下列有关实验说法不正确的是______________。(填编号)
A.减压过滤使用的滤纸,为确保把所有的孔都覆盖住,应使滤纸大于布氏漏斗内径
B.为得到干燥的乳酸亚铁晶体,采用高温烘干的方式干燥
C.洗涤CuCl沉淀时,关小抽气泵,向布氏漏斗中加乙醇没过沉淀,并用玻璃棒搅拌
D.为得到较大的乳酸亚铁晶体颗粒,可投入几粒晶种并减缓溶液冷却速度
(4)若向NaHCO3溶液中加入FeSO4溶液,得到的FeCO3不纯,其原因是___________。
(5)用高锰酸钾标准液测定乳酸亚铁产品纯度,配制该标准溶液时,下列仪器中不必要用到的有_________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
下列操作会引起结果偏高的是____________(用编号表示)。
A.滴定前,滴定管和锥形瓶分别用标准液与待测液润洗
B.配制高锰酸钾溶液定容时,仰视刻度线
C.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
D.加待测液前锥形瓶内有少量水
E.滴定前俯视读数,滴定后仰视读数
(6)由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,_______。(需要用到下列所有操作,给出正确的顺序)
①滤液加热至60℃左右 ②趁热过滤 ③过滤 ④用乙醇洗净所得固体
⑤滴加加0.1mol·L-1H2SO4至pH为2.0~2.5 ⑥置于真空干燥箱中干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO2、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
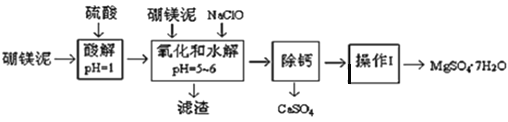
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有_________________。(写2个)
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为主要原料合成重要的有机化合物路线如下图所示。请回答下列问题。
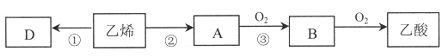
(1)乙烯的结构简式__________________,空间构型_____________________。
(2)A物质所含官能团的名称是____________________。
(3)反应②的反应类型是__________________________。
(4)反应③的化学方程式是___________________________________________。
(5)以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是___________________。
(6)下列物质中,可以通过乙烯加成反应得到的是___________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com