
| A. | 沸点由高到低:HF>HCl | B. | 熔点由高到低:K>Li | ||
| C. | 硬度由大到小:金刚石>晶体硅 | D. | 晶格能由大到小:NaF>NaCl |
分析 A.HF分子之间含氢键;
B.碱金属单质的熔点从上到下减小;
C.原子晶体中,半径小的硬度大;
D.离子晶体中,离子键小的晶格能大.
解答 解:A.HF分子之间含氢键,则沸点由高到低:HF>HCl,故A正确;
B.碱金属单质的熔点从上到下减小,则熔点由高到低:Li>K,故B错误;
C.原子晶体中,半径小的硬度大,半径为C<Si,则硬度由大到小:金刚石>晶体硅,故C正确;
D.离子晶体中,离子键小的晶格能大,离子半径F-<Cl-,则晶格能由大到小:NaF>NaCl,故D正确;
故选B.
点评 本题考查周期表和周期律及物质结构,为高频考点,把握性质的比较方法、物质结构与性质等为解答该题的关键,侧重分析与应用能力的考查,注意晶体类型及性质比较,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
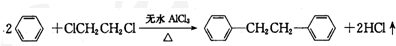
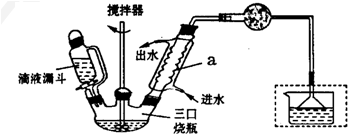
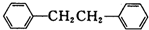 )是一种重要的有机合成中间体,实验室可用苯和1,2-二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2-二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: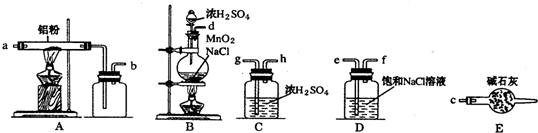
| 名称 | 相对分子质量 | 密度/(g•cm-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一般情况下,σ键比π键重叠程度大,形成的共价键更强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 气体单质分子中,一定有σ键,可能有π键 | |
| D. | 杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
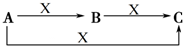 A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:
A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | B. | 由青蒿素( )合成双氢青蒿素( )合成双氢青蒿素( )的反应 )的反应 | ||
| C. | 空气净化器过滤净化空气 | D. | 消毒柜通电产生臭氧的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | 非金属性:Z>W | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于水解,溶液中n(SO32-)<0.1mol | |
| B. | 加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) | |
| D. | 2c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com