
| A. | 碱性溶液中:Rb+、Cs+、CH3COO-、Br- | B. | 饱和溴水中 I-、NO3-、Na+、SO32- | ||
| C. | D+、Cl-、NO3-、SiO32- | D. | Ag+、Fe3+、Br-、SO42- |
分析 A.碱性溶液中,该组离子之间不反应;
B.溴水具有氧化性,不能存在还原性离子;
C.离子之间结合生成沉淀;
D.离子之间结合生成沉淀.
解答 解:A.碱性溶液中,该组离子之间不反应,可大量共存,故A错误;
B.溴水具有氧化性,与I-、SO32-发生氧化还原反应,或NO3-、I-(或SO32-)发生氧化还原反应,不能共存,故B错误;
C.D+、SiO32-结合生成沉淀,不能共存,故C错误;
D.Ag+分别与Br-、SO42-结合生成沉淀,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应及离子的颜色为解答的关键,侧重复分解反应、氧化还原反应的离子共存及分析与应用能力的考查,题目难度不大.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 4:3 | C. | 3:2 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
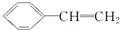 )有下列叙述:
)有下列叙述:| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| B. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,Rn元素的相对原子质量是222 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 112号元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
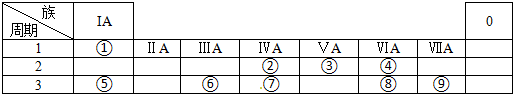
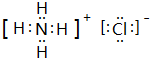 ,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).
,化学键类型有离子键、极性键(填“离子键”“极性键”或“非极性键”).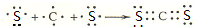 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com