
在900℃的空气中合成出一种含镧、钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:
⑴ 准确移取25.00 mL 0.05301 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5 mL 6 mol·L-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。
⑵ 准确称取0.4460 g复合氧化物样品,放入锥形瓶中,加25.00 mL上述草酸钠溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。
⑴2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O
KMnO4溶液浓度:![]() = 0.01910 (mol·L-1)
= 0.01910 (mol·L-1)
⑵根据:化合物中金属离子摩尔比为 La : Ca : Mn = 2 : 2 : 1,镧和钙的氧化态分别为+3和+2,锰的氧化态为 +2 ~ +4,初步判断
复合氧化物的化学式为La2Ca2MnO6+x, 其中 x = 0~1。
滴定情况:
加入C2O42-总量:25.00 mL ×0.05301 mol·L-1= 1.3253 mmol
样品溶解后,滴定消耗高锰酸钾:10.02 mL ×0.01910 mol·L-1 = 0.1914 mmol
样品溶解后剩余C2O42-量: 0.1914 mmol × ![]() = 0.4785 mmol
= 0.4785 mmol
样品溶解过程所消耗的C2O42-量: 1.3253 mmol -0.4785 mmol = 0.8468 mmol
在溶样过程中,C2O42-变为CO2给出电子:
2 × 0.8468 mmol = 1.694 mmol
有两种求解x的方法:
(1)方程法:
复合氧化物(La2Ca2MnO6+x)样品的物质的量为:
0.4460 g / [(508.9 + 16.0 x) g·mol-1]
La2Ca2MnO6+x中,锰的价态为: [2 ×(6+x) -2 ×3 -2×2] = (2+2x)
溶样过程中锰的价态变化为: (2+2 x - 2) = 2 x
锰得电子数与C2O42-给电子数相等:
2 x× 0.4460 g / [(508.9 + 16.0 x) g·mol-1] = 2 ×0.8468 ?? 10-3 mol
x = 1.012 ≈ 1
(2)尝试法
因为溶样过程消耗了相当量的C2O42-,可见锰的价态肯定不会是+2价。若设锰的价态为+3价,相应氧化物的化学式为La2Ca2MnO6.5, 此化学式式量为516.9 g·mol-1, 称取样品的物质的量为:
0.4460 g / (516.9 g·mol-1) = 8.628 ×10-4 mol
在溶样过程中锰的价态变化为
1.689× 10-3 mol / (8. 628×10-4 mol) = 1.96
锰在复合氧化物中的价态为: 2 + 1.96 = 3.96
3.96与3差别很大,+3价假设不成立;
而结果提示Mn更接近于+4价。
若设Mn为+4价, 相应氧化物的化学式为La2Ca2MnO7, 此化学式式量为524.9 g· mol-1。
锰在复合氧化物中的价态为:2 + 2 × 0.8468 ×10-3 / (0.4460 / 524.9) = 3.99 ≈ 4
假设与结果吻合,可见在复合氧化物中,Mn为+4价。
该复合氧化物的化学式为La2Ca2MnO7
溶样过程的反应方程式为:
La2Ca2MnO7 + C2O42- + 14H+ = 2La3+ + 2Ca2+ + Mn2+ + 2CO2 + 7H2O
⑴ 此过程为标准溶液的标定,根据关系式5C2O42-~2MnO4-,用C2O42-标准溶液标定出MnO4-的浓度。
⑵该分析过程属于容量分析的返滴定类型,用KMnO4滴定过量的C2O42-。根据电子得失守恒关系,可列出下式
Mn元素得失电子数+5×n(MnO4-)=2×n(C2O42-)
求得Mn元素得失电子的物质的量为1.694 mmol
设复合氧化物的通式(La2Ca2MnO6+x),求得氧化物中Mn的物质的量,进而求得滴定过程中锰元素氧化数的变化,最终确定氧化物中锰的氧化数。


科目:高中化学 来源: 题型:阅读理解
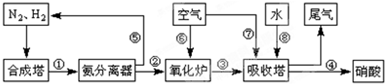
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
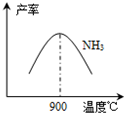
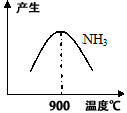
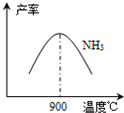 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市石景山区高三统一测试(理综)化学部分 题型:填空题
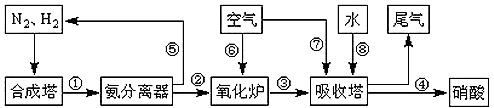
(16分)工业合成氨与制备硝酸一般可连续生产,流程如下:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。t℃时,往1L密闭容器中充入0.2mol
CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= (填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol
CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= (填计算结果)。
(2)合成培中发生反应N2(g)+3H2(g) 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
300℃(填“>”、“<”或“=”)。
|
T/℃ |
T1 |
300 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(3) N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示。温度高于900℃时,NH3产率下降的原因 。
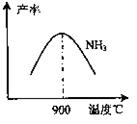
(4)在上述流程图中,氧化炉中发生反应的化学方程式为 。
(5)硝酸厂的尾气含有氮的氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H= -574kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将N02还原为N2的热化学方程式为: 。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式 ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:石景山区一模 题型:问答题
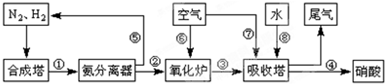
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源:浙江省月考题 题型:填空题
 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。 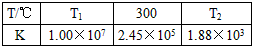
查看答案和解析>>
科目:高中化学 来源:北京模拟题 题型:填空题

 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。 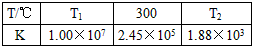

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com