
| A、HCO3-→CO2 |
| B、Cl-→Cl2 |
| C、MnO4-→Mn2+ |
| D、Fe3+→Fe2+ |
科目:高中化学 来源: 题型:


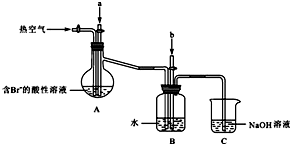
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C+CO2=2CO |
| B、Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3?H2O+8H2O |
| C、CaC2+2H2O=Ca(OH)2+C2H2 |
| D、CH4+2 O2=CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、氧化剂与还原剂物质的量比为1:5 |
| C、Cl2既做氧化剂又做还原剂 |
| D、3molCl2完全反应电子转移5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 0.01mol?L-1 酸性KMnO4溶液 |
0.1mol?L-1 H2C2O4溶液 |
水 | 1mol?L-1 MnSO4溶液 |
反应温度/℃ | 反应时间 |
| I | 2ml | 2ml | 0 | 0 | 20 | 125 |
| II | 1ml | 0 | 20 | 320 | ||
| III | 0 | 50 | 30 | |||
| IV | 2ml | 2ml | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol烷烃(CnH2n+2)中含有共用电子对为0.3nNA |
| B、0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA |
| C、标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA |
| D、电解精炼铜时,电解池中每转移1mol电子时,阳极上溶解的铜原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应量取Na2CO3?10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com