
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)第③步Cr3+与氢氧根离子结合生成沉淀;
(3)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少;
(7)电镀时阴极上溶液中金属离子得电子得到金属单质.
解答 解:(1)c(OH-)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O左移,溶液呈黄色,
故答案为:黄;
(2)第③步Cr3+与氢氧根离子结合生成沉淀,其反应的离子方程式为:Cr3++3OH-=Cr(OH)3↓;
故答案为:Cr3++3OH-=Cr(OH)3↓;
(3)用6mol的FeSO4•7H2O作还原剂,转移6mol电子,则可以还原1mol Cr2O72-离子;
故答案为:1;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\root{3}{\frac{Ksp}{c(C{r}^{3+})}}$=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:Fe-2e-=Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;
故答案为:2H++2e-=H2↑;
(7)电镀时阴极上溶液中金属离子得电子得到金属单质,则用电镀法在铁制品上镀上一层锌,则阴极上锌离子得电子生成Zn,其电极反应式为Zn2++2e-=Zn;
故答案为:Zn2++2e-=Zn.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键,注意把握溶度积常数的有关计算,侧重考查学生的分析能力、应用能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
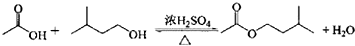
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
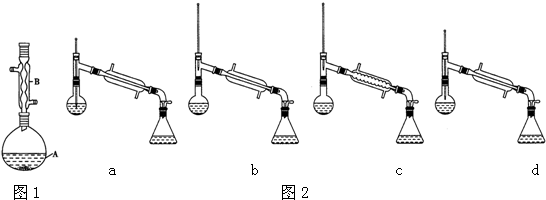
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
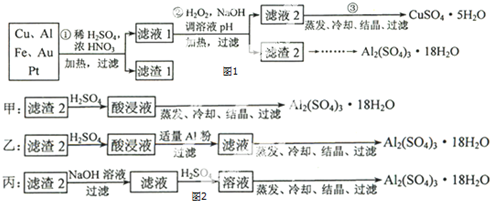
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②⑤⑥⑧ | C. | ②③⑥⑧ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
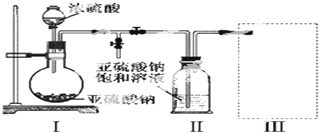
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活注重节能减排,减少温室气体的排放 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com