
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答: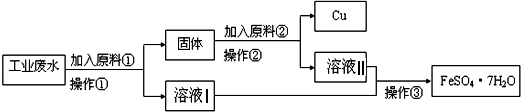
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
【答案】
(1)Fe+Cu2+=Fe2++Cu
(2)abc
(3)铁、铜
(4)稀硫酸,O2,Cu,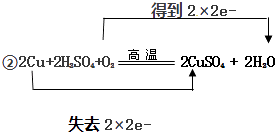
【解析】解:Ⅰ、(1)根据题意知,该物质能和铜离子反应且不引进新的杂质离子,所以物质为铁,铁与铜离子反应的离子方程式为:Cu2++Fe═Cu+Fe2+,
故答案为:Cu2++Fe═Cu+Fe2+;
(2)操作②的分离是固体、液体分离,所以应用过滤的方法,故用到的玻璃仪器有:a.烧杯b.漏斗c.玻璃棒,
故答案为:abc;
(3)操作①中加入过量的铁才能使铜离子完全反应Cu2++Fe═Cu+Fe2+,所以所得固体的成分是铁和铜,
故答案为:铁、铜;
(4)操作①中加入过量的铁才能使铜离子完全反应,所以所得固体的成分是铁和铜,分离铁和铜且回收铜,所以加入某物质与铁反应,与铜不反应,且与铁反应后的物质与操作①所得溶液中溶质的成分一样,加入的物质为稀硫酸,
故答案为:稀硫酸;
Ⅱ、①2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,O2得电子化合价降低(0→﹣2)是氧化剂,Cu失电子化合价升高(0→+2)是还原剂,
2CuSO4+2H2O反应中,O2得电子化合价降低(0→﹣2)是氧化剂,Cu失电子化合价升高(0→+2)是还原剂,
故答案为:O2;Cu;
②2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中氧气为氧化剂,O元素的化合价0→﹣2,铜为还原剂,Cu元素的化合价0→+2,转移电子数为:4e﹣,用双线桥表示为:
2CuSO4+2H2O反应中氧气为氧化剂,O元素的化合价0→﹣2,铜为还原剂,Cu元素的化合价0→+2,转移电子数为:4e﹣,用双线桥表示为: 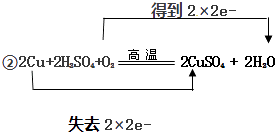 ,
,
故答案为:  .
.
Ⅰ、(1)根据题意知,该物质能和铜离子反应且不引进新的杂质离子,所以物质为铁;(2)操作②的分离是固体、液体分离,所以应用过滤的方法,故用到的玻璃仪器有:a.烧杯b.漏斗c.玻璃棒;(3)操作①中加入过量的铁才能使铜离子完全反应Cu2++Fe═Cu+Fe2+,所以所得固体的成分是铁和铜;(4)操作①中加入过量的铁才能使铜离子完全反应,所以所得固体的成分是铁和铜,分离铁和铜且回收铜,所以加入某物质与铁反应,与铜不反应,且与铁反应后的物质与操作①所得溶液中溶质的成分一样,加入的物质为稀硫酸;Ⅱ、①根据元素化合价的升降进行解答;②根据电子的转移方向解答。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在相同温度下,0.01molL﹣1 NaOH溶液和0.01molL﹣1的盐酸相比,下列说法正确的是( )
A.由水电离出的[H+]相等
B.由水电离出的[H+]都是1.0×10﹣12 molL﹣1
C.由水电离出的[OH﹣]都是0.01 molL﹣1
D.两者都促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纤维素、纤维素酶、DNA的基本组成单位分别是
A. 葡萄糖、氨基酸和脱氧核苷酸
B. 葡萄糖、葡萄糖和氨基酸
C. 氨基酸、氨基酸和脱氧核苷酸
D. 淀粉、蛋白质和脱氧核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)C单质分子的结构式 ______________________;
(3)元素D与元素A相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是 ______(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _______________,试写出Y与H2O2溶液反应的化学方程式: __________________________________________;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+F2═2HF
B.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
C.NaOH+HCl═NaCl+H2O
D.4HNO3 ![]() 2H2O+4NO2↑+O2↑
2H2O+4NO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂动力电池(LiFePO4电池)是一种新型动力电池。电池的内部结构如图所示。中间是聚合物的隔膜,它把正极与负极隔开,Li+可以通过而e-不能通过。该电池的总反应式为:Li1-xFePO4+LixC6![]() C6 +LiFePO4 (注:LixC6是单质Li附在碳电极上的一种形式)。下列关于该电池的叙述错误的是
C6 +LiFePO4 (注:LixC6是单质Li附在碳电极上的一种形式)。下列关于该电池的叙述错误的是

A. 放电时, LixC6在负极上失电子发生氧化反应
B. 在充电时,正极中的Li+通过聚合物隔膜向负极迁移
C. 放电时,正极反应式为Li1-xFePO4+xLi+= LiFePO4-xe-
D. 若用该电池电解精炼铜,阴极质量增重19.2kg时,则电池中通过聚合物隔膜的Li+数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于微量元素的一组是( )
A. C、H、N、P、Mn B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo D. N、P、K、Cu、Fe、I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式正确的是
A. 纯碱溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O
C. 向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4
D. 碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com