
 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.分析 (1)①CH3OH(g)+H2O(l)═CO2(g)+3H2(g);△H=+93.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
③CH3OH(g)═CH3OH(l);△H=-38.19kJ•mol-1
将方程式3②-③-2①得CH3OH(l )+$\frac{3}{2}$O2 (g)=CO2(g)+2H2O (l),焓变进行相应的改变;
(2)CH3OH燃料碱性电池中,负极上CH3OH失电子和OH-反应生成CO32-和H2O;
(3)①石墨作电极电解硫酸铜溶液,Y是阳极,阳极上OH-失电子生成O2和H2O;
②X、Y分别是石墨、Cu,Cu作阳极,电解硫酸铜溶液,阳极上Cu失电子发生氧化反应,阴极上铜离子得电子发生还原反应,根据转移电子守恒计算消耗空气体积;
(4)①该反应中Mn元素化合价由+7价变为+2价,C元素化合价由+3价变为+4价,根据元素守恒知,产物中还有水生成,酸性条件下高锰酸钾溶液具有强氧化性,所以还需要氢离子参加反应,根据电荷守恒、转移电子守恒及原子守恒配平方程式;
②c两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,可得离子浓度间的大小关系.
解答 解:(1)①CH3OH(g)+H2O(l)═CO2(g)+3H2(g);△H=+93.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
③CH3OH(g)═CH3OH(l);△H=-38.19kJ•mol-1
将方程式3②-③-2①得CH3OH(l )+$\frac{3}{2}$O2 (g)=CO2(g)+2H2O (l),△H=3(-192.9kJ•mol-1)-(-38.19kJ•mol-1)-2(+93.0kJ•mol-1)=-726.51 kJ•mol-1
故答案为:CH3OH(l )+$\frac{3}{2}$O2 (g)=CO2(g)+2H2O (l)△H=-726.51 kJ•mol-1 ;
(2)燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)①石墨作电极电解硫酸铜溶液,Y是阳极,阳极上OH-失电子生成O2和H2O,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
②若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=$\frac{128g}{64g/mol}$,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=$\frac{\frac{4mol}{4}}{22.4L/mol}$÷20%=112L,故答案为:112;
(4)①该反应中Mn元素化合价由+7价变为+2价,C元素化合价由+3价变为+4价,根据元素守恒知,产物中还有水生成,酸性条件下高锰酸钾溶液具有强氧化性,转移电子数为10,所以还需要氢离子参加反应,根据电荷守恒、转移电子守恒及原子守恒配平方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;5;6H+;2;10;8H2O;
②n(H2C2O4•2H2O)=$\frac{2.52g}{126g/mol}$=0.02mol,n(NaOH)=0.2mol/L×0.1L=0.02mol,两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,而溶液中还存在着水的电离,故H+>C2O42-,由于离子的电离程度较小,则有HC2O4->H+,故正确顺序为Na+>HC2O4->H+>C2O42->OH-,
故答案为:Na+>HC2O4->H+>C2O42->OH-.
点评 本题考查较综合,涉及酸碱中和定性判断、氧化还原反应配平、电解原理、盖斯定律等知识点,为高频考点,明确化学反应原理及基本计算方法是解本题关键,难点是离子浓度大小比较、电极反应式的书写,注意转移电子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
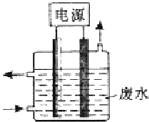 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极附近碱性增强,阳极附近碱性减弱 | |
| D. | 除去CN-的反应:5ClO-+2CN-+2H+═N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸在溶液中主要的电离方程式:H2SO3?H ++HSO3- | |
| B. | 用铁棒作阳极电解饱和氯化钠溶液的反应:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 热的纯碱溶液可以清洗油污的原因:CO32-+H2O?HCO3-+OH- | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe一2e-═Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
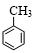 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$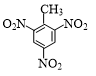 +3H2O.
+3H2O.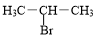 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$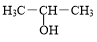 +NaBr.
+NaBr.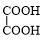 +
+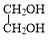 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com