
【题目】环之间共用一个碳原子的化合物称为螺环化合物。科学家最近在-100℃的低温下合成一种螺环烃X,其分子结构如图所示(图中的连线表示化学键)。下列关于X的叙述错误的是

A. X分子中所有原子均在同一平面上
B. 生成lmolC5H12至少需要4molH2
C. X与乙烯含有相同的官能团,可发生氧化反应
D. 充分燃烧等物质的量的X和甲烷,X消耗氧气较多
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
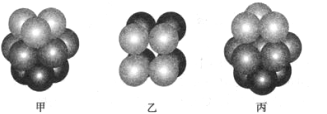
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:
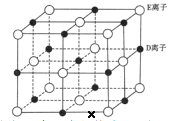
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对反应类型的判断不正确的是
A. CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H20 氧化反应
CH3COONH4+2Ag↓+3NH3+H20 氧化反应
B. ![]() 聚合反应
聚合反应
C. 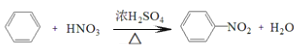 取代反应
取代反应
D. 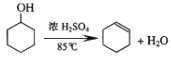 消去反应
消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
c(CO)/molL-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
完成下列填空:
(1)写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。
(2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(Ls);达到平衡时,CO 的转化率为:_____。
(3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”);
若往(NH4)2SO4溶液中再加入少量稀盐酸,则c(NH4+)/c(SO42-)值将_____(填“变大”、“变小”或“不变”)。
(4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。
(5)向另一种可溶性钡盐溶液中通入少量SO2气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是( )
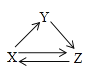
物质 选项 | X | Y | Z |
A | Al | Al2O3 | NaAlO2 |
B | Fe | FeCl3 | FeCl2 |
C | C | CO | CO2 |
D | Cl2 | HCl | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性
B. 油脂是高级脂肪酸的甘油酯,在常温下均呈固态
C. CH3CH(NH2)COOH既能与盐酸反应、又能与氢氧化钠溶液反应
D. 合成橡胶![]() 的单体之一是CH3-C≡C-CH3
的单体之一是CH3-C≡C-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题:
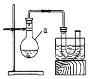
(1)仪器a的名称是________。
(2)在大烧杯中加入冰水的目的是________。
(3)加入碎瓷片的作用是________。
(4)为了更好的控制温度,选择常用的加热方式为________。
(5)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,生成的无色刺激性气味气体的分子式为________。
(6)U形管内可观察到的现象是_____________。
(7)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.苯
(8)检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 92gNO2和N2O4混合气体中含有的原子数为3NA
B. 71g氯气与足量铁粉充分反应,转移的电子数为3 NA
C. 0.5mol·L-1的Ba(OH)2溶液中OH-的数目为NA
D. 1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由乙烯推测丙烯的结构或性质中,正确的是
A. 分子中所有原子都在同一平面上 B. 不能发生氧化反应
C. 与HCl加成只生成一种产物 D. 能发生加聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com