
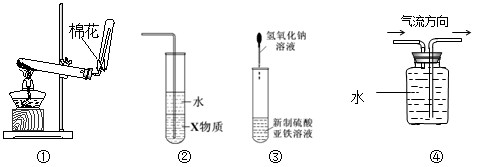
| A.实验室常用装置①制取NH3 |
| B.装置②中X若为CCl4,可用于吸收NH3,并防止倒吸 |
| C.装置③可用于制备Fe(OH)2并较长时间观察其白色 |
| D.装置④可用于收集NO |
科目:高中化学 来源:不详 题型:单选题
| A.萃取操作可在普通漏斗中完成 |
| B.浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 |
| C.闻未知液体或气体的气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻搧动。 |
| D.用容量瓶配制好一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸测量溶液的pH值时要先将试纸润湿 |
| B.滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口如果试纸不变蓝说明原溶液中无NH4+ |
| C.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
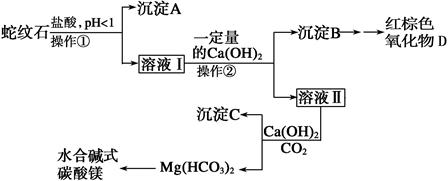
科目:高中化学 来源:不详 题型:实验题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.③④⑤ | C.①②④ | D.①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com