
【题目】(1)在________mL 0.2 mol/L NaOH溶液中含1 g溶质;配制480 mL 0.2 mol/L CuSO4溶液,需要用托盘天平称量CuSO4·5H2O _________g。( 已知:NaOH-40 CuSO4-160 )
(2)取100 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到29.02 g白色沉淀,用过量稀盐酸处理后沉淀量减少到9.32 g,并有气体放出。原混合溶液中Na2SO4的物质的量浓度为________mol·L-1;产生的气体在标准状况下的体积为________L。( 已知:BaCO3-197 BaSO4-233)
(3)在实验室将16.8g固体NaHCO3加热一段时间后,测得剩余固体的质量变为13.7g.则有______ g NaHCO3固体发生了分解反应。若继续对剩余固体加热,至不再产生气体后,冷却后的固体的质量是________ g。( 已知:NaHCO3-84 Na2CO3-106 )
(4)向1L AlCl3和FeCl3混合溶液中加入含6 mol NaOH的溶液时,产生的沉淀量可达最大值,继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到7mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为_______ mol/L。
【答案】125 25.0 0.4 2.24 8.4 10.6 1
【解析】
(1)根据V=n/c,m=nM=cVM计算得出。
(2)根据Na2CO3+ BaCl2=BaCO3↓+2NaCl,Na2SO4+ BaCl2= BaSO4↓+2NaCl来解答。
(3)固体质量减轻16.8g-13.7g=3.1g,减轻的质量是水和二氧化碳的质量。
(4)根据Al(OH)3+OH-=AlO2-+2H2O,Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓来解答。
(1)1 gNaOH的物质的量为1/40 mol,根据n=cV,可得V=n/c=(1/40 mol)/ 0.2 mol·L-1=0.125L=125 mL,配制480 mL 0.2 mol/L CuSO4溶液,需用500 mL容量瓶,m=nM=cVM= 0.2 mol/L×0.5L×250g/mol=25g,故答案为:125 ;25.0 。
(2)Na2CO3+ BaCl2=BaCO3↓+2NaCl,Na2SO4+ BaCl2= BaSO4↓+2NaCl,白色沉淀是碳酸钡和硫酸钡的质量之和,用过量稀盐酸处理后沉淀量减少到9.32 g,为硫酸钡的质量,故n(BaSO4)=9.32g/233g/mol=0.04mol,碳酸钡的质量为29.02 g-9.32 g=19.7g,故n(Ba CO3)=19.7g/197g/mol=0.1mol,根据原子守恒n(Na2SO4)=n(BaSO4)=0.04mol,故c(Na2SO4)=0.4 mol·L-1,根据碳原子守恒n(CO2)=n(Na2CO3)=0.1mol,标准状况下的体积为2.24L,故答案为:0.4 ;2.24。
(3)固体质量减轻16.8g-13.7g=3.1g,减轻的质量是水和二氧化碳的质量,
2NaHCO3![]() Na2CO3+H2O+ CO2↑
Na2CO3+H2O+ CO2↑
168 62
x 3.1g
x=8.4g。
若继续对剩余固体加热,至不再产生气体后,最终得到的固体为碳酸钠,
2NaHCO3![]() Na2CO3+H2O+ CO2↑
Na2CO3+H2O+ CO2↑
168 106
16.8g y
y= 10.6g。
故答案为:8.4 ;10.6。
(4)当前后加入的NaOH总量达到7mol时,沉淀不再减少,发生Al(OH)3+OH-=AlO2-+2H2O,则n (AlCl3)= n[Al(OH)3]= 7mol-6 mol=1mol,反应Al3++3OH-=Al(OH)3↓,消耗3molNaOH,则反应Fe3++3OH-=Fe(OH)3↓消耗NaOH的物质的量为3mol,所以n(FeCl3)=1mol,c(Fe3+)=1mol/1L= 1mol/L,故答案为:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A.除去BaSO4中少量BaCO3:加入足量盐酸,充分反应后,过滤、洗涤、干燥
B.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
C.除去CO2气体中混有的CO气体:混合气通过灼热的铜网
D.除去KI溶液中的碘单质:加入乙醇萃取后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅢA族的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)基态Ga原子价电子排布图为________.
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)铵盐大多不稳定,NH4F、NH4I中,较易分解的是_____,原因是______.
(4)第二周期中,第一电离能介于B元素和N元素之间的元素有______种。
(5)晶体别有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见下图),每个顶点为一个硼原子,每个三角形均为等边三角形。若此结构单元为1个分子,则其分子式为____.

(6)冰晶石(Na3AlF6)由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,ο位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_________ (填微粒符号)。
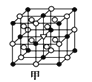
(7)A1单质的晶体中原子的堆积方式如图乙所示,其晶跑特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若己知Al的原子半径为dnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目_____个;Al晶体的密度为_____g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系:
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石(Na3A1F6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:

(1)Na3AlF6中氟、铝以共价键结合,写出Na3A1F6中所含阳离子的电子式____________,滤渣A的主要成分是___________(填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:

①实验3比实验2获得。Na2SiF6的质量低的原因可能是_________________________。
②选择“酸浸”时所采用的最适合条件为_____________________。
(3)写出反应③的离子方程式:______________________________。
(4)“操作i”不能用硅酸盐质设备进行分离的原因_____________________________。
(5)经测定,操作i所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+_____(填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3A1F6)=6.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pAg=-lgc(Ag+),pCl=-1gc(C1-),根据不同温度下氯化银饱和溶液的PAg和pCl 可绘制图像如右图所示,且己知氯化银的溶解度随温度的升高而增大,根据该图像,下列表述正确的是

A. T3 >T2 >T1
B. 将A点的溶液降温,可能得到C 点的饱和溶液
C. 向B点所表示的溶液中加入氯化钠溶液,溶液可能改变至D点
D. A点表示的是T 1温度下的不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)已知氢气在氧气中燃烧生成3.6g液态水放热57.16kJ的热量,请写出表示氢气燃烧热的热化学方程式___________________________;若断开H2(g)中1molH-H需要吸收436kJ的能量,生成H2O(g)中的1mol H-O键放出463 kJ的能量,18g液态水转化为水蒸气需要吸收44 kJ的能量,则断开1molO2中的共价键需要吸收___________kJ的能量。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的正极反应式:___
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______
(4)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
a.容器内气体压强保持不变
b. 1 mol MHx能够吸收ymol H2
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则c(H2)增大
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①请写出阳极电极反应式________________________
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,请分析在实验中控制NaOH浓度为14mol/L的原因:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com