
| A.Q1=2Q2=92.4 | B.92.4 >Ql>2Q2 | C.92.4=Q1>2Q2 | D.92.4 >Q1=2Q2 |
 2 NH3(气) ΔH=-92.4 kJ/mol . ①向密闭容器甲中通入1 molN2和3 mol H2,由于该反应是可逆反应,反应物不可能完全转化为生成物,所以达到平衡时放出热量Q1kJ<92.4 kJ÷2。②由于反应是在容积相同且恒容的密闭容器中进行。若平衡不发生移动,由于物质的量为①的一半,放出的热量也是原来的一半。但是由于该反应的正反应是气体体积减小的反应。物质的量减少,压强减小,根据平衡移动原理:减小压强,化学平衡向逆反应方向移动,所以放出的热量要比一半少。因此热量关系为92.4 >Ql>2Q2。故选项为B。
2 NH3(气) ΔH=-92.4 kJ/mol . ①向密闭容器甲中通入1 molN2和3 mol H2,由于该反应是可逆反应,反应物不可能完全转化为生成物,所以达到平衡时放出热量Q1kJ<92.4 kJ÷2。②由于反应是在容积相同且恒容的密闭容器中进行。若平衡不发生移动,由于物质的量为①的一半,放出的热量也是原来的一半。但是由于该反应的正反应是气体体积减小的反应。物质的量减少,压强减小,根据平衡移动原理:减小压强,化学平衡向逆反应方向移动,所以放出的热量要比一半少。因此热量关系为92.4 >Ql>2Q2。故选项为B。

科目:高中化学 来源:不详 题型:单选题
| A.Q1+Q2<Q3 | B.Q1+Q2>2Q3 |
| C.Q1+Q2=2Q3 | D.Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (图中的
(图中的 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
 的热化学方程式为 。
的热化学方程式为 。 = KJ·mol-1
= KJ·mol-1| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 198 | 360 | 498 | x |
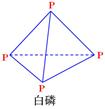 (P4O10)
(P4O10)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.C+CO2 2CO 2CO |
C.CaCO3 CaO+CO2↑ CaO+CO2↑ |
D.C+H2O CO+H2 CO+H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③ | C.①④⑤ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1,3—环己二烯加氢是吸热反应 | B.1,3—环己二烯比苯稳定 |
| C.苯比1,3—环己二烯稳定 | D.苯加氢生成环己烷是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OCH3(g)+H2O(g) ΔH="-25" kJ/mol,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g) ΔH="-25" kJ/mol,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| C/(mo/L) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.2A+B=2C ΔH<0 |
| B.2C=2A+B ΔH<0 |
| C.2A(g)+B(g)=2C(g) ΔH>0 |
| D.2A(g)+B(g)=2C(g) ΔH<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq)
H2O(l) ΔH=Q1 kJ·mol-1,又知:H2SO4(aq)+2KOH(aq) K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )
K2SO4(aq)+2H2O(l)ΔH=Q2 kJ·mol-1。则Q1和Q2的关系是( )| A.Q1=Q2 | B.2Q1=Q2 | C.Q1<Q2 | D.无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com