
下列叙述不正确的是( )
A.液氯是纯净物,氯水是混合物
B.漂白粉的主要成分是Ca(ClO)2和CaCl2
C.Ca(ClO)2比HClO不稳定
D.氢气在氯气中燃烧生成的气体溶于水中形成盐酸
科目:高中化学 来源: 题型:
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.定容时俯视液面 B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)为了测定一定质量氯化钠样品中硫酸钠杂质的含量,将样品配成溶液,先加入过量的氯化钡溶液,然后过滤、洗涤、烘干、称量,通过硫酸钡的质量计算出硫酸钠的含量。回答下列问题:
①为什么加入过量的氯化钡溶液?
②如何判断氯化钡溶液已过量?
③如何洗涤沉淀? 。
(2)用量筒量取一定体积的液体时,若采用俯视的方法量取20 mL液体,则实际量取的液体的体积比20 mL ,若量筒中实际有20 mL液体,而你读数时采用了俯视的方法,则读得的数据比20 mL 。
(3)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验现象所得出的结论不正确的是( )
A.无色溶液使紫色石蕊试液变蓝;结论:溶液一定呈碱性
B.无色溶液焰色反应呈紫色(透过蓝色钴玻璃观察),结论:溶液中一定含有K+
C.在无色溶液中加入Na2CO3溶液产生白色沉淀;结论:溶液中一定含有Ca2+
D.在无色盐溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝;结论:溶液一定含有NH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯、溴、碘的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
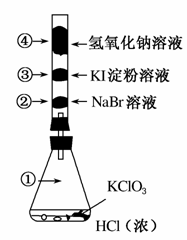
① ② ③ ④
A.黄绿色 橙色 蓝色 白色
B.无色 橙色 紫色 白色
C.黄绿色 橙色 蓝色 无色
D.黄绿色 无色 紫色 白色
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种易溶于水的物质,分别由NH 、Ba2+、Mg2+、H+、OH-、Cl-、HCO
、Ba2+、Mg2+、H+、OH-、Cl-、HCO 、SO
、SO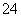 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
A.甲溶液含有Ba2+ B.乙溶液含有SO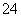
C.丙溶液含有Cl- D.丁溶液含有Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废气中的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一.为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3—→N2+H2O来消除污染.有关此反应,下列说法中错误的是
A.N2既是氧化产物又是还原产物
B.当x=1时,每生成2.5 mol N2,被氧化的气体有3 mol
C.当x=2时,有1 mol气体被还原,转移电子4 mol
D.反应通式配平表示为:6NOx+4xNH3===(3+2x)N2+6xH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外研究小组用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程如图所示:
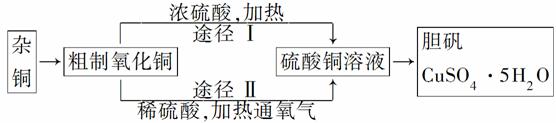
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(填写下列所给仪器的编号,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿
e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是________(填选项字母)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤有:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com