
工业上通常以铝土矿(主要成分为Al2O3)为原料制备无水氯化铝:2Al2O3+6Cl2 4AlCl3+3O2
↑。请回答下列问题:
4AlCl3+3O2
↑。请回答下列问题:
(1)上述反应涉及的元素中,最外层有2个未成对电子的元素是__________;简单离子的离子半径最小的元素,其原子核外有_____种不同能级的电子。
(2)已知元素周期表中,镓(31Ga)与铝元素同一主族,写出Ga的最外层电子排布式:______
(3)镓(Ga)有两种天然同位素,一种是 ,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
(4)为促进反应的进行,实际生产中需加入焦炭,其原因是 。
(1)氧(O) ;5 (各1分,共2分)
(2)4s24p 1 (2分)
(3)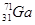 (2分)
(2分)
(4)碳与O2反应,有利于反应正向进行 (2分)
【解析】
试题分析:(1)Al、O、Cl元素原子外围电子排布分别为为3s23p1、2s22p4、3s23p5,故氧元素原子最外层有2个未成对电子。电子层数越多微粒半径越大,在核外电子排布相同的条件下,核电荷数越多,微粒半径越小,所以简单离子的离子半径最小的元素为Al元素,核外电子排布式为1s22s22p63s23p1,核外有5种不同能级的电子。
(2)镓(31Ga)与铝元素同一主族,铝的原子序数是13,因此镓7元素的原子序数是13+18=31,处于第四周期,最外层电子数为3,所以Ga的最外层电子排布式为4s24p1。
(3)溴化镓(GaBr3)的摩尔质量309.8g/mol,则镓元素的相对原子质量为309.8-80×3=69.8。设镓的另一种同位素的质量数为A,则根据元素原子所占的百分比可知,0.4A+0.6×69=69.8,解得A=71,故该同位素为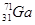
(4)实际生成中加入焦炭,碳与O2反应,降低氧气的浓度,有利于反应正向进行。
考点:考查核外电子排布规律、微粒半径半径、同位素质量数的计算、化学平衡移动等


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| ||


| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:




| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
69 31 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省宁波市高一上学期期末化学试卷(解析版) 题型:填空题
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝,流程如下,回答下列问题:
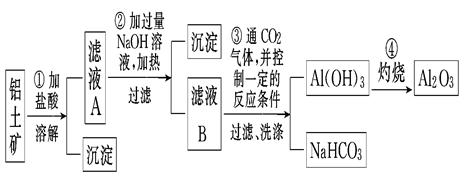
(1)画出Al的原子结构示意图 。
(2)写出反应①中主要成分发生反应的化学方程式: 。
(3)写出滤液B中溶质的化学式 。
(4)甲同学在实验室中用如左下图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。乙同学分析认为:甲同学通入的CO2中含有HCl气体,是导致实验失败的原因。乙同学认为在实验装置Ⅰ和装置Ⅱ之间增加右下图装置可解决这个问题。请在右下图装置的横线上注明试剂名称。

(5)工业上通常以铝土矿提取得到的Al2O3为原料制备无水氯化铝:
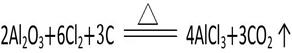
该反应中的还原剂是 ,若制得22.4 L(标准状况下)CO2气体时,则有 mol电子发生转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com