
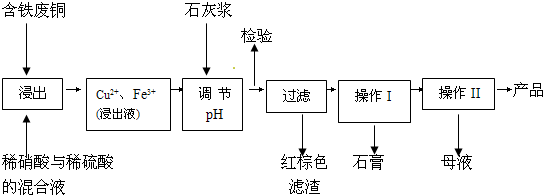
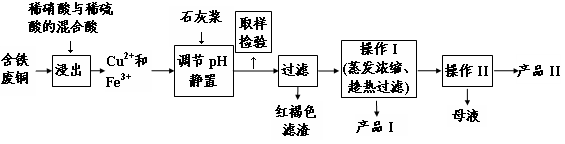
��16�֣�ʵ�����ɺ�����ͭΪԭ������������CuSO4��5H2O����ʯ�ࣨCaSO4��2H2O����ʵ��������ͼ��ʾ��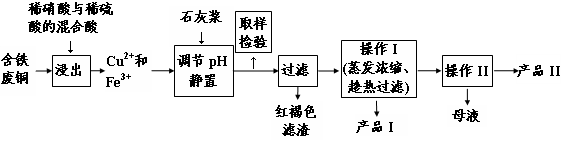
��������ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ�����±���
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8[ | 83.8 | 114 |
 2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ��
2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ��| ��� | ʵ����� | Ԥ������ͽ��� |
| �� | ���Թ��м�������FeCl3��Һ�� ������������������KI��Һ�� | ���ɫ���ڳ��� |
| �� | ���Թ��еĻ����Һת���� �����������У�����һ������ �� �� | |
| �� | | |
��1��Fe(OH)3��2�֣� ��2��100��2�֣� ��3����ȴ�ᾧ ϴ�ӣ�2�֣�
��4����10�֣���� ʵ����� Ԥ������ͽ��� �� ������2�֣� �� ��Һ©����1�֣���CCl4��1�֣�����ס�������������ȡ�������ã�1�֣� Һ��ֲ㣬�ϲ�ӽ���ɫ���²��Ϻ�ɫ��1�֣� �� �������ȷų��²�Һ�壬�ٴӷ�Һ©�����Ͽ��е���ˮ�����Թ��У�����KSCN��Һ��2�֣� ����Ѫ��ɫ����Ӧ��Ļ�����к�Fe3+������֤�����ȷ��һ�����淴Ӧ����֮��Fe3+������֤������һ�����淴Ӧ��2�֣�
����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��16�֣�ʵ�����ɺ�����ͭΪԭ������������CuSO4��5H2O����ʯ�ࣨCaSO4��2H2O����ʵ��������ͼ��ʾ��
��������ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ�����±���
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8[ | 83.8 | 114 |
��ش��������⣺
��1�����ɫ��������Ҫ�ɷ��� ��д��ѧʽ����
��2���ڽ��в���Iʱ������¶��� �档
��3������Һ�з������ƷII�IJ���IIӦΪ �����ˡ� �����
��4��ȡ�����鲽���м������Fe3+������Fe3+���������Լ��Ǵ����֪��KSCN�����Լ��������Fe3+��������KI�����飺2Fe3++2I��2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ��
| ��� | ʵ����� | Ԥ������ͽ��� |
| �� | ���Թ��м�������FeCl3��Һ�� ������������������KI��Һ�� | ���ɫ���ڳ��� |
| �� | ���Թ��еĻ����Һת���� �����������У�����һ������ �� �� |
|
| �� |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2011-2012ѧ��㶫ʡ�ع��и�����ѧ�ڵڶ��ε��п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣�ʵ�����ɺ�����ͭΪԭ������������CuSO4��5H2O����ʯ�ࣨCaSO4��2H2O����ʵ��������ͼ��ʾ��
��������ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ�����±���
|
�¶ȣ��棩 |
20 |
40 |
60 |
80 |
100 |
|
ʯ�� |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
���� |
32 |
44.6 |
61.8[ |
83.8 |
114 |
��ش��������⣺
��1�����ɫ��������Ҫ�ɷ��� ��д��ѧʽ����
��2���ڽ��в���Iʱ������¶��� �档
��3������Һ�з������ƷII�IJ���IIӦΪ �����ˡ� �����
��4��ȡ�����鲽���м������Fe3+������Fe3+���������Լ��Ǵ����֪��KSCN�����Լ��������Fe3+��������KI�����飺2Fe3++2I�� 2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ��
2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ��
|
��� |
ʵ����� |
Ԥ������ͽ��� |
|
�� |
���Թ��м�������FeCl3��Һ�� ������������������KI��Һ�� |
���ɫ���ڳ��� |
|
�� |
���Թ��еĻ����Һת���� �����������У�����һ������ �� �� |
|
|
�� |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㶫ʡģ���� ���ͣ�ʵ����


 2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ��
2Fe2++I2����������Ϊ�������һ�����淴Ӧ��Fe3+��I����Ӧ�����Һ�����ɫ������I2����KI��Һ����ɫ��Ϊ̽�������ɫ��Һ���Ƿ�Fe3+������֤�����Ƿ���һ�����淴Ӧ��������ʵ���ҳ�����������Ʒ�������Լ���Ʒ�������дλ�ڴ�������±���0.1 mol/L��FeCl3��KI��KSCN��NaOH��H2SO4��KMnO4��Һ��CCl4������ˮ�� 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com