
某小组的同学对放置已久的过氧化钠的成分进行探究,请回答下列问题:
(1)反应2Na2O2+2H2O===4NaOH+O2↑的还原剂是________(写化学式);反应2Na2O2+2CO2===2Na2CO3+O2中,每生成1 mol O2转移________mol电子。
(2)进行探究:
①提出假设。
假设1:全部是Na2O2
假设2:全部是Na2CO3
假设3:________________
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、1 mol·L-1 H2SO4溶液、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯、胶头滴管。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,滴加足量1 mol·L-1 H2SO4溶液,然后将内壁附有澄清石灰水的烧杯罩于试管口 | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则______________________ |
步骤2: |
|
步骤3: |
|
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:____________________________________;由R生成Q的化学方程式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题2常用化学计量--物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列叙述错误的是( )。
A.标准状况下,11.2 L氢气中含有1 mol质子
B.12 g金刚石含有的共价键数为4NA
C.46 g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列叙述正确的是( )。
A.盐酸和食醋既是化合物又是酸
B.纯碱、CuSO4·5H2O和生石灰分别属于盐、混合物和氧化物
C.胶体处于介稳定状态,所以放置一会便会有沉淀生成
D.胶体区别于其他分散系的本质特征是分散质粒子直径的大小
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题13化学实验综合应用练习卷(解析版) 题型:实验题
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是
____________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为______________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
操作 | 现象 |
|
|
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
操作 | 现象 |
向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
操作 | 现象 |
向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是_____________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
下列叙述中不正确的是( )。
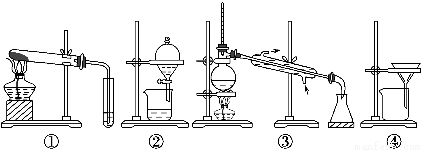
A.可用装置①除去碳酸钠中的碳酸氢钠
B.可用装置②分离汽油和水的混合物
C.可用装置③从海水中蒸馏得到淡水
D.可用装置④把胶体粒子从分散系中分离出来
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是 ( )。

A.关闭活塞1,加入稀硝酸至液面a处
B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.乙烯和聚乙烯都可与溴水发生加成反应
B.用酸性KMnO4溶液能鉴别乙烷和乙烯
C.(NH4)2SO4、CuSO4都能使蛋白质变性
D.葡萄糖、蔗糖都能与新制的Cu(OH)2反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:

①该反应的平衡常数的表达式为K=________。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
③在下图a、b、c三点中,H2的转化率由高到低的顺序是________(填字母)。

(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com