
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )

A.甲 B.乙 C.丙 D.丁
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4 ④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>②>①
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市高三上学期第一次月考化学试卷(解析版) 题型:选择题
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )

A. 3 :1 B.2 :3 C.6 :1 D.1 :3
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三暑假阶段性考试化学试卷(解析版) 题型:填空题
(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量的是________mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 __,又变为棕黄色的原因是用离子方程式解释_________________。
(3)在 100 mLFeBr2 溶液中通入标准状况下2.24 L Cl2,溶液中有 1/4的 Br-被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为________。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 _,反应中生成0.2 mol HNO3,转移的电子数目为_______________________。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三暑假阶段性考试化学试卷(解析版) 题型:选择题
铋(Bi)位于元素周期表中第ⅤA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应实验现象如表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI?淀粉溶液 |
实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三暑假阶段性考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA
B.Na2O2与足量的水反应生成1 mol O2,转移电子数目为2NA
C.某密闭容器中有2 mol SO2和1 mol O2,在一定条件下充分反应,转移的电子数为4NA
D.18 g重水(D2O)所含的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市高三上第二次月考化学试卷(解析版) 题型:填空题
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
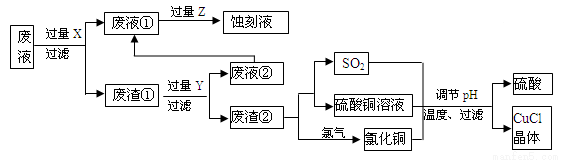
按要求回答下列问题:
⑴ 废液①的主要含有的金属阳离子是__________(填化学符号,下同);废渣①的成分是_____________,Y为__________。
⑵废液①与Z反应的离子方程式为:______________________。
⑶ 写出废渣②生成二氧化硫的化学方程式_____________________。
⑷ 为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
⑸ 生产过程中调节溶液的pH不能过大的原因是___________________。
⑹ 写出产生CuCl的离子方程式_______________________。
⑺ 氯化亚铜的定量分析:
① 称取样品0.25g加入10mL过量的FeCl3溶液250mlL锥形瓶中,不断摇动;
② 待样品溶解后,加水50mL和2滴指示剂;
③ 立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④ 重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
则CuCl的纯度为____________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市高三上第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.石灰石、生石灰、熟石灰均属于碱
B.Na2O、MgO、Al2O3均属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上9月月考化学卷(解析版) 题型:选择题
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com