
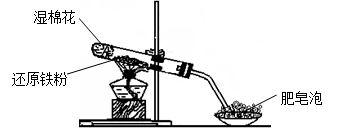
 Fe3O4+4H2(2分) (2)Fe3O4和Fe(2分)
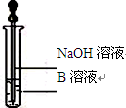
Fe3O4+4H2(2分) (2)Fe3O4和Fe(2分) Fe3O4+4H2,(2)滴加几滴KSCN溶液,结果溶液未变红色,说明该溶液中并没有铁离子,说明铁离子被铁还原为亚铁离子,所以固体物质的成分为Fe3O4和Fe;(3)B溶液中含有亚铁离子,所以加入NaOH溶液,生产了白色的氢氧化亚铁沉淀,由于氢氧化亚铁不稳定,其在空气中能够被氧化为红褐色的氢氧化铁沉淀,所以相关的反应的化学方程式为:FeSO4+2NaOH==Na2SO4+2Fe(OH) 2↓、4Fe(OH) 2+ O2+2H2O==4Fe(OH) 3 ;(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明有铁离子的生成,所以说明了亚铁离子具有还原性;故在实验室中FeSO4溶液要临时配制并加少量铁粉的原因是为了防止亚铁离子被氧化,其离子方程式为2Fe3++ Fe==3Fe2+ 。
Fe3O4+4H2,(2)滴加几滴KSCN溶液,结果溶液未变红色,说明该溶液中并没有铁离子,说明铁离子被铁还原为亚铁离子,所以固体物质的成分为Fe3O4和Fe;(3)B溶液中含有亚铁离子,所以加入NaOH溶液,生产了白色的氢氧化亚铁沉淀,由于氢氧化亚铁不稳定,其在空气中能够被氧化为红褐色的氢氧化铁沉淀,所以相关的反应的化学方程式为:FeSO4+2NaOH==Na2SO4+2Fe(OH) 2↓、4Fe(OH) 2+ O2+2H2O==4Fe(OH) 3 ;(4)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明有铁离子的生成,所以说明了亚铁离子具有还原性;故在实验室中FeSO4溶液要临时配制并加少量铁粉的原因是为了防止亚铁离子被氧化,其离子方程式为2Fe3++ Fe==3Fe2+ 。

 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:不详 题型:单选题
| A.原混合物中n(Fe)∶n(Fe2O3)=3∶1 |
| B.反应后溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
| C.实际参加反应HCl的物质的量为0.08mol |
| D.向溶液中滴入KSCN溶液,显红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
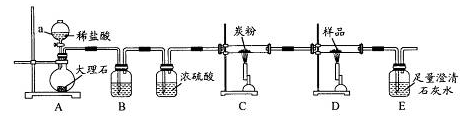
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
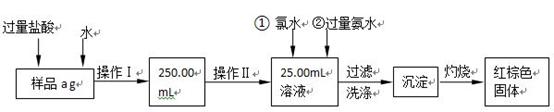
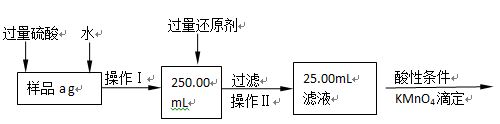
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
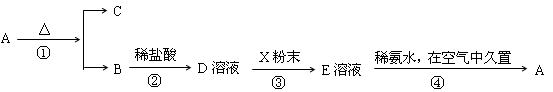
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com