
 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )| A. | 在A、B间任意一点(不包括A、B两点):c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 在B点:c(A-)=c(K+)>c(OH-)=c(H+),且a=7.5 | |
| C. | 在C点:c(A-)>c(K+)>c(OH-)>c(H+) | |
| D. | 在D点:c(A -)+c(HA)>2 c(K+) |
分析 A.开始时c(OH-)>c(HCOO-),所以A、B之间不一定满足c(HCOO-)>c(OH-);
B.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,溶液显示碱性,欲显中性,甲酸应该稍过量,则有a>7.5;
C.在C点甲酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(HCOO-)>c(K+);
D.点甲酸过量,所加入甲酸的物质的量大于KOH的物质的量的2倍,根据物料守恒进行判断.
解答 解:A.在A、B间任意一点,因为开始时c(OH-)>c(HCOO-),即有可能存在:c(K+)>c(OH-)>c(HCOO-)>c(H+),故A错误;
B.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,反应生成甲酸钠溶液,溶液显示碱性,若溶液为中性,则c(OH-)=c(H+),根据电荷守恒c(K+)=c(HCOO-),由于溶液中存在部分甲酸,则应该满足a>7.5,故B错误;
C.C点甲酸过量,溶液呈酸性,c(H+)>c(OH-),由电荷守恒可得c(HCOO-)>c(K+),所以溶液中离子浓度大小为:c(HCOO-)>c(K+)>c(H+)>c(OH-),故C错误;
D.D点甲酸过量,所加入甲酸的物质的量为:0.02L×0.2mol/L═0.004mol,KOH的物质的量为:0.015L×0.1mol/L=0.0015mol,根据物料守恒,则反应后溶液中一定满足:c(HCOO-)+c(HCOOH)>2c(K+),故D正确;
故选D.
点评 本题考查离子浓度大小比较、酸碱混合溶液PH的判断与计算,题目难度中等,注意从电解质的强弱以及酸碱混合反应的角度分析,注意分析曲线的变化特点,明确电荷守恒、物料守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
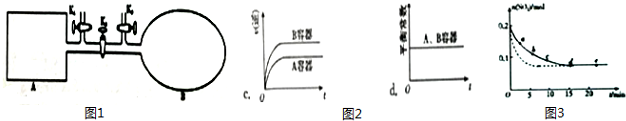
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com