
| A. | 甲烷结构的比例模型: | B. | 羟基的电子式: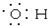 | ||
| C. | 羧基的结构简式: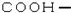 | D. | 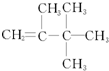 的名称:2,3,3-三甲基-1-丁烯 的名称:2,3,3-三甲基-1-丁烯 |
分析 A.比例模型能够体现出分子的空间结构及各原子相对体积大小,据此判断甲烷的比例模型;
B.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接;
C.羧基由羰基和羟基组成,H只能形成一个共价键;
D.根据烯烃的命名原则分析,该烃含有双键的最长碳链碳数为4,为丁烯,在2号碳上含有1个甲基,在3号碳上含有2个甲基,双键位于1、2号碳之间.
解答 解:A.甲烷为正四面体结构,碳原子半径大于氢原子,则甲烷的比例模型为: ,故A正确;
,故A正确;
B.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为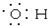 ,故B正确;
,故B正确;
C.因氢原子最外层只有1个电子,则只能形成一个共价键,则羧基的结构简式为-COOH,故C错误;
D. 该烃含有双键的最长碳链碳数为4,为丁烯,在2号碳上含有1个甲基,在3号碳上含有2个甲基,双键位于1、2号碳之间,名称:2,3,3-三甲基-1-丁烯,故D正确;
该烃含有双键的最长碳链碳数为4,为丁烯,在2号碳上含有1个甲基,在3号碳上含有2个甲基,双键位于1、2号碳之间,名称:2,3,3-三甲基-1-丁烯,故D正确;
故选C.
点评 本题考查了常见化学用语的判断,题目难度不大,注意掌握比例模型、电子式、结构简式、烃的命名等化学用语的表示方法,试题有利于培养学生规范答题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应 | |
| B. | 我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3置换反应 | |
| C. | 用天然气作燃料 CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 氧化反应 | |
| D. | 证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 40 g NaOH溶解在1 L水中,所制得的溶液,物质的量浓度为1 mol•L-1 | |
| C. | 标准状况下,11.2 L四氯化碳所含分子数为0.5NA | |
| D. | 常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ①④⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2L水中溶有80克的NaOH | B. | 80克NaOH溶于2L水配成的溶液 | ||
| C. | 每升溶液中含有80克NaOH | D. | 每2L溶液中含有80克NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | SO2(HCl):NaOH溶液 | D. | NaHCO3溶液(Na2CO3):Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com