
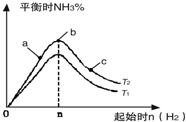
分析 ①增加氢气的物质的量化学平衡向着正反应方向移动;
②当反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;化学平衡状态是反应物的转化率最大、生成物的产率最大;先求出各自的平衡浓度,然后根据化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$计算.
解答 解:①氢气的物质的量越多,化学平衡越向正反应方向移动,氮气的转化率越大,a、b、c点氢气物质的量大小顺序是a<b<c,所以氮气转化率大小顺序是c>b>a,故答案为:c;
②当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为$\frac{n}{3}$,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1,mol/l,变化的氢气浓度为1.8mol/l,变化的氮气浓度为0.6mol/l,平衡时氮气、氢气、氨气的浓度分别是0.4mol/l、1.2mol/l、1.2mol/l,化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$=$\frac{1.{2}^{2}}{0.4×1.{2}^{3}}$=2.08,
故答案为:$\frac{n}{3}$;2.08.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响,为高频考点,侧重考查学生分析计算能力,注意:当反应物的物质的量之比等于计量数之比时反应物的转化率相同、产物的含量最大,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体带正电荷,因此能发生电泳现象 | |
| B. | Fe(OH)3胶体与FeCl3溶液的本质区别是胶体粒子直径在1-100nm之间 | |
| C. | 将FeCl3溶液加入到沸水中能制得Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体和CuSO4溶液都能发生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| B. | 氧化钠投入水中发生反应:O2-+H2O═2OH- | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ag2SO4 | FeS | CuS | Ag2S | |
| Ksp | 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
| A. | 相同温度下,Ag2SO4、FeS、CuS饱和溶液中:c(Cu2+)>c(Fe2+)>c(Ag+) | |
| B. | 向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:S2-+Cu2+=CuS↓ | |
| C. | 浓度均为0.004mol•L-1的AgNO3和H2SO4溶液等体积混合后不能产生沉淀 | |
| D. | 向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com