
分析 根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4和H2SO4的物质的量浓度;混合后溶液中c(H+)=2c(H2SO4);溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)═c(CuSO4)+c(H2SO4);向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-).
解答 解:把2.0mol•L-1CuSO4和1.0mol•L-1H2SO4溶液等体积混合,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1}{2}$×2.0mol/L=1.0 mol/L,c(H2SO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L,混合后溶液中c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,混合后溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)=c(CuSO4)+c(H2SO4)=1.0mol/L+0.5mol/L=1.5mol/L,向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
答:反应后溶液中Fe2+的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解稀释定律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 除⑥外 | B. | 除⑤.⑥.⑦.⑧外 | C. | ①.②.⑥.⑦ | D. | ①.③.⑥.⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的H2SO4溶液中含有H+的数目为0.2NA | |
| B. | 过氧化钠与水反应时,生成0.1molO2转移电子0.2NA | |
| C. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| D. | 3.36LCO2和O2的混合气体所含的氧原子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
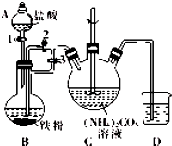 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va=Vb时:c(CH3COO-)=c(K+) | |
| B. | Va<Vb时:c(CH3COOH)+c(H+)=c(OH-) | |
| C. | Va>Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中能大量存在:Na+、K+、Cl-、HCO3- | |
| B. | 加入金属铝后溶液中有大量气泡产生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+ Na+ AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com