
(9分)根据图所示的化学反应框图解题。
(1)单质F是__________,溶液H中所含的主要离子是_________________________。
(2)写出下列反应的化学方程式:
C+L―→F+E:_ _ ____,
B―→F+H:_____ ___ ______。
(3)写出下列反应的离子方程式:
E+Cl2―→G:____ ____________ _______,
G+C―→E:____ ___ ________,
D―→H:__________________________________ ________。
(4)由C―→E+F若改用浓酸,则不能选用的浓酸是_____ ___(填化学式)。
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:阅读理解
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省红色六校高三第一次联考化学试卷(解析版) 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
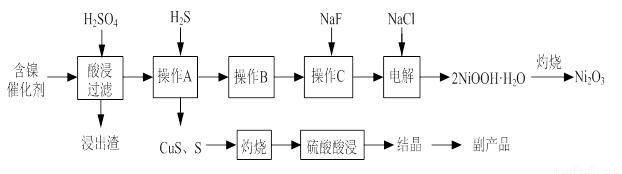
图Ⅰ 图Ⅱ
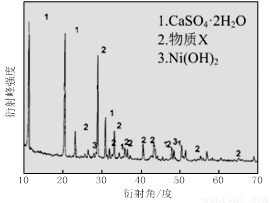
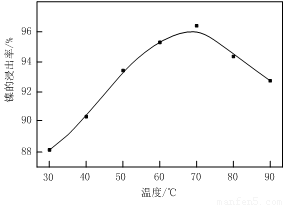
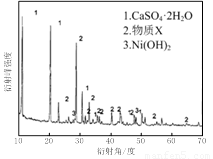
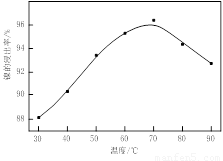
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
开始沉淀的pH |
1.5 |
6.5 |
7.7 |
|
沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 ______mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
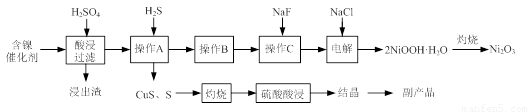
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
开始沉淀的pH |
1.5 |
6.5 |
7.7 |
|
沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高三上学期第一次练考化学试卷(解析版) 题型:填空题
(9分)根据图所示的化学反应框图解题。

(1)单质F是__________,溶液H中所含的主要离子是_________________________。
(2)写出下列反应的化学方程式:
C+L―→F+E:_ _ ____,
B―→F+H:_____ ___ ______。
(3)写出下列反应的离子方程式:
E+Cl2―→G:____ ____________ _______,
G+C―→E:____ ___ ________,
D―→H:__________________________________ ________。
(4)由C―→E+F若改用浓酸,则不能选用的浓酸是_____ ___(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com