
| A. | 异戊二烯CH2═C(CH3)CH═CH2与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(CH3CH2CHClCH3)与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下生成一硝基取代物的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
分析 A、二烯烃与溴单质加成反应时可以发生1,2加成、1,4加成分析判断;
B、消去反应的实质是和相邻碳原子上的氢原子消去小分子形成双键分析判断.
C、甲苯在苯环上存在邻、间、对位置的氢可以被取代分析;
D、羧基能与碳酸氢钠反应,酚羟基不与碳酸氢钠反应.
解答 解:A、异戊二烯CH2═C(CH3)CH═CH2与等物质的量的Br2发生加成反应,可以发生1,2-加成,1,4-加成得到两种同分异构体,故产物存在同分异构体,故A不符合;
B、2-氯丁烷(CH3CH2CClHCH3)与NaOH乙醇溶液共热发生消去HCl分子的反应,可以从1号碳上消去氢原子形成双键,也可以从3号碳原子上消去氢原子形成双键,得到两种同分异构体,故产物存在同分异构体,故B不符合;
C、甲苯在一定条件下发生硝化生成一硝基甲苯的反应中 可以生成邻硝基甲苯、间硝基甲苯、对硝基甲苯三种一硝基取代产物,故生成物存在同分异构体,故C不符合;
D、邻羟基苯甲酸与NaHCO3溶液反应时分子中的酚羟基不反应,只有羧基和碳酸氢钠反应生成邻羟基苯甲酸钠,二氧化碳和水,产物一定不存在同分异构,故D符合;
故选D.
点评 本题考查了反应生成物质的不同方式,同分异构体的概念,主要从官能团的化学性质考查反应的实质,关键是理解消去反应、取代反应、二烯加成反应的含义和产物判断.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

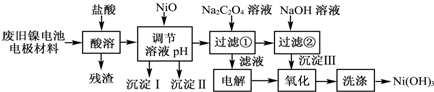
| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用氢氧化钠溶液吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+、ClO-、SO42-、I- | |
| B. | 由水电离的c(H+)=l×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、CO32-、SO32-、NO3 | |
| D. | 无色透明的溶液中:K+、Cu2+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48LHF,则转移0.8mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应 Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | Ca(ClO)2溶液中通入少量二氧化碳:ClO-+H2O+CO2=HClO+CO32- | |
| D. | 向氯化铝溶液中滴入足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com