
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )| A. | 该物质遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol | |
| D. | 该分子中的所有碳原子不可能共平面 |
分析 A.含有酚羟基的物质遇FeCl3溶液呈紫色;
B.碳碳双键、酚-OH、变化连接的甲基均能被酸性KMnO4溶液氧化;
C.碳碳双键与溴发生加成反应,酚羟基邻位、对位的氢原子发生取代反应;苯环、碳碳双键均与氢气发生加成反应;
D.苯环与碳碳双键的平面结构通过旋转碳碳单键可以处于同一平面内.
解答 解:A.含酚羟基,遇FeCl3溶液呈紫色,故A正确;
B.碳碳双键、酚-OH、变化连接的甲基均能被酸性KMnO4溶液氧化,不能能证明其结构中存在碳碳双键,故B错误;
C.酚-OH的邻对位与溴水发生取代,碳碳双键与溴水发生加成,则1mol该物质与浓溴水反应,消耗溴为4mol;苯环与碳碳双键均与氢气发生加成,则1mol该物质与氢气反应时,消耗氢气为7mol,故C正确;
D.苯环、碳碳双键均为平面结构,且直接相连的原子在同一平面内,通过旋转碳碳单键可以使3个平面处于同一平面内,则该分子中的所有碳原子可能共平面,故D错误.
故选AC.
点评 本题考查有机物的官能团及其性质,明确有机物的结构与性质的关系即可解答,注意酚与溴发生取代反应,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中Cl-离子浓度为0.2mol•L-1 | |
| B. | 1L溶液中Ba2+离子浓度为0.2mol•L-1 | |
| C. | 1L溶液中Cl-离子总数为0.2NA | |
| D. | 1L溶液中Ba2+和Cl-离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
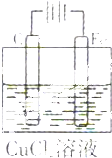
| A. | C棒是阴极 | B. | Cu2+向C棒电极移动 | ||
| C. | Fe电极发生还原反应 | D. | 溶液颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2,4-二甲基己烷 | |
| B. |  2-甲基-4-戊炔 | |
| C. |  3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题:
氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题: 2-.
2-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com